盐泥是氯碱工业中的废渣,主要含有镁、铁、铝、钙等的硅酸盐和碳酸盐。实验室以盐泥为原料制取MgSO4·7H2O的流程如下:

已知:(Ⅰ) Ksp[Mg(OH)2]=6.0×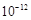
(Ⅱ) Fe2+、Fe3+、Al3+开始沉淀到完全沉淀的pH范围依次为:7.1~9.6、2.0~3.7、3.1~4.7
(Ⅲ) 三种化合物的溶解度(S)随温度变化曲线如图。

回答下列问题:
(1)在盐泥中加H2SO4溶液控制pH为1~2以及第一次煮沸的目的是: 。
(2)若溶液中Mg2+的浓度为6 mol/L,溶液pH≥ 才可能产生Mg(OH)2沉淀。
(3)第二次过滤需要趁热进行,主要原因是 。所得滤渣的主要成分是 。
(4)从滤液Ⅱ中获得MgSO4·7H2O晶体的实验操作步骤为:①向滤液Ⅱ中加入 ,②过滤,得沉淀,③ ,④蒸发浓缩,降温结晶,⑤过滤、洗涤得产品。
(5)若获得的MgSO4·7H2O质量为24.6 g,则该盐泥中含镁[以Mg(OH)2计]的百分含量约 (MgSO4·7H2O式量为246)
(15分)
(1)提高Mg2+的浸取率(2分)
(2)8(2分)
(3)温度较高时钙盐与镁盐分离更彻底(或高温下CaSO4·2H2O溶解度小)(2分)
Al(OH)3、Fe(OH)3、CaSO4·2H2O (2分)
(4)NaOH溶液(2分) 向沉淀中加足量稀硫酸(2分)
(5)20.0%(3分)
题目分析:由流程图,①②③酸浸,溶解,④分离溶液和固体杂质,主要是H2SiO3和不溶解的滤渣,⑤将Fe2+ 氧化成Fe3+ 以便分步除去,⑥分离Fe (OH)3、Al (OH)3和MgSO4、NaCl溶液,由滤液Ⅱ得到产品。⑴通过煮沸提高反应速率,提高Mg2+ 的浸出率,答案:提高Mg2+的浸取率;⑵Ksp[Mg(OH)2]=6.0×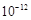 =c(Mg2+)c2(OH― )得:c2(OH― )= 6.0×
=c(Mg2+)c2(OH― )得:c2(OH― )= 6.0×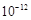 /6=1.0×10-12,c(OH― )=1.0×10―6mol/L,PH
/6=1.0×10-12,c(OH― )=1.0×10―6mol/L,PH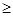 8,答案:8;⑶从图中读出高温下CaSO4·2H2O溶解度小,与溶液分离更彻底,答案:温度较高时钙盐与镁盐分离更彻底(或高温下CaSO4·2H2O溶解度小); Al(OH)3、Fe(OH)3、CaSO4·2H2O;⑷滤液Ⅱ中含有MgSO4、NaCl,要将NaCl分离出去,要先将Mg2+ 形成Mg(OH)2沉淀,过滤后将NaCl除去,然后加H2SO4重新生成MgSO4,然后蒸发浓缩,降温结晶,过滤、洗涤、干燥后获得晶体。答案:NaOH溶液;向沉淀中加足量稀硫酸;⑸MgSO4·7H2O质量为24.6 g,是0.1mol,则0.1molMg (OH)2为5.8 g,5.8g/29g×100%=20.0%。答案:20.0%。
8,答案:8;⑶从图中读出高温下CaSO4·2H2O溶解度小,与溶液分离更彻底,答案:温度较高时钙盐与镁盐分离更彻底(或高温下CaSO4·2H2O溶解度小); Al(OH)3、Fe(OH)3、CaSO4·2H2O;⑷滤液Ⅱ中含有MgSO4、NaCl,要将NaCl分离出去,要先将Mg2+ 形成Mg(OH)2沉淀,过滤后将NaCl除去,然后加H2SO4重新生成MgSO4,然后蒸发浓缩,降温结晶,过滤、洗涤、干燥后获得晶体。答案:NaOH溶液;向沉淀中加足量稀硫酸;⑸MgSO4·7H2O质量为24.6 g,是0.1mol,则0.1molMg (OH)2为5.8 g,5.8g/29g×100%=20.0%。答案:20.0%。
