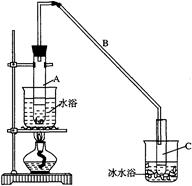
某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯:
已知: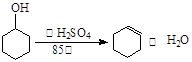
| 密度 (g/cm3) | 熔点 (℃) | 沸点 (℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是 ,导管B除了导气外还具有的作用是 。
②试管C置于冰水浴中的目的是 。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在 层(填“上”或“下”),分液后用 (填入编号)洗涤。
A.KMnO4溶液 B.稀H2SO4 C.Na2CO3溶液
②再将环己烯按图装置蒸馏,冷却水从 口进入。蒸馏时要加入生石灰,目的是: 。
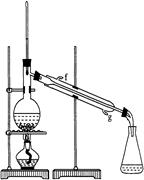
③收集产品时,控制的温度应在 左右,实验制得的环己烯精品质量低于理论产量,可能的原因是 _______
A.蒸馏时从70℃开始收集产品 B.环己醇实际用量多了
C.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是_______
A.用酸性高锰酸钾溶液 B.用金属钠 C.测定沸点
(4)由环己烯再转化为环己醇的化学方程式为:______________
(1) ①防止暴沸; 冷凝。 ②防止环己烯的挥发。
(2) ①上; C。 ②g;除去水分。 ③ 83℃ ; C。
(3)B、C。
(4)环己烯 + H2O——环己醇
题目分析:(1)①加热液体时,为了防止液体爆沸,常采用加入沸石或碎瓷片;易挥发的物质反应时为提高其利用率,一般要有冷凝回流装置,导管B即是起到这种作用;②反应生成的产物沸点较高,易挥发,应采用冰水冷却,防止环己烯的挥发;(2)①烃的密度比水小,与水混合时,环己烯在上层;要除去产品中的酸杂质,可用碳酸钠等碱性溶液除去;②实验中一般采用逆流冷却,蒸馏时加入生石灰目的是与水反应,防止与产品一起蒸馏出;③收集产品时,控制的温度应让环己烯挥发出来,而2环己醇等留在溶液中,理论温度可控制在83℃——161℃,又因为是水浴加热和能量的消耗等方面可控制温度低一些 83℃即可;实验制得的环己烯精品质量低于理论产量,说明环己烯或环己醇损失了,故答案为C;(3)粗品中含有环己醇能与钠反应,且混合物沸点不固定,与环己烯沸点不同。
