过氧化钙晶体(CaO2·8H2O)呈白色,微溶于水,加热至350℃左右开
始分解放出氧气。过氧化钙可用于改善地表水质、处理含重金属粒子废水、应急供
氧等。实验室可用工业碳酸钙(含MgCO3、FeCO3等杂质)制取纯净的碳酸钙,然后再
用纯的碳酸钙制取过氧化钙,其主要流程如下:
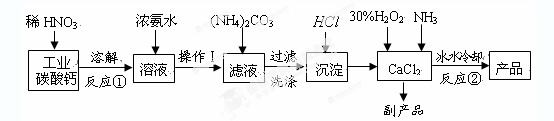
回答下列问题:
整个流程中涉及的化学反应属于氧化还原反应的有 个,请写出其中任意一个的离子方程式: ;
(2)反应②生成CaO2·8H2O的化学反应方程式为 ;
反应时用冰水冷却的主要原因是 ;
(3)将过氧化钙晶体在坩埚中加热并逐渐升高温度。测得样品质量随温度的变化如图曲线所示,则350℃以后所得固体物质的化学式为 。

(1)3FeCO3+10H++NO3-=3Fe3++NO↑+3CO2↑+5H2O
(2)CaCl2+H2O2+2NH3+8H2O=CaO2·8H2O+2NH4Cl
防止H2O2分解,提高其利用率或降低CaO2·8H2O溶解度,提高产率
(3)CaO
题目分析:(1)只有反应①中的FeCO3与硝酸反应是氧化还原反应,反应为
3FeCO3+10H++NO3-=3Fe3++NO↑+3CO2↑+5H2O
(2)该反应的反应物为CaCl2、H2O2、NH3,故方程式为CaCl2+H2O2+2NH3+8H2O=CaO2·8H2O+2NH4Cl
因为H2O2受热易分解,故采用冰水冷却的方式防止其分解,提高利用率,同时温度低能较低溶解度,提高产率。
(3)在加热过程中固体中钙元素的量不变,固体由2.16g加热到350℃变为0.56g,
n(Ca)="2.16÷216=0.01mol" m(CaO) =0.01×56=0.56g 故该固体为CaO
(这样的解法是一种猜测,该题可以先计算失去全部结晶水时质量,再由此计算质量差得出化学式)
