(12分)某化学兴趣小组为了探究锌与浓硫酸反应生成气体的成分做了如下实验:
将50g锌粉与50mL浓H2SO4在加热条件下充分反应,锌粉有剩余,收集到一定体积的气体,将该气体体积折算成标准状况为11.2L。
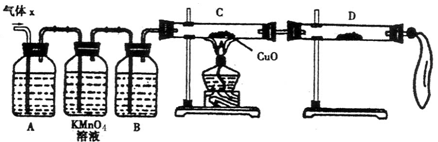
(1)化学兴趣小组所制得的气体X中混有的主要杂质气体可能是
(填分子式)。产生这种结果的主要原因是(用离子方程式表示) 。
(2)实验验证:为了检验主要杂质气体的成分,化学兴趣小组的同学设计了如下实验,对气体X取样进行探究。
①A中加入的试剂可能是 ,作用是 。
B中加入的试剂可能是 。
②证实气体X中混有杂质气体,D中应选择的试剂是 ,同时应观察到C中的实验现象是 。
(3)理论分析:
①该小组有同学提出只需要再测出一个数据,便能准确的确定该气体的组成,你认为他可以是测下列 。
A、反应后剩余锌的质量为17.5g
B、收集到气体的质量为25.8g
C、浓硫酸的物质的量浓度为18.0mol/L
②根据你在①中所选数据,通过计算确定气体X中各成分物质的量分别为: 。
(12分)
(1)H2 Zn+2H+=Zn2++H2↑(2分)
(2)①NaOH溶液(或其他合理答案) ,吸收SO2气体,浓H2SO4
②无水CuSO4,黑色固体变红
(3)①BC ②SO2为0.4mol,H2为0.1mol
锌与浓硫酸可生成SO2气体:①Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O
当浓硫酸逐渐变为稀硫酸时,生成H2:②Zn+H2SO4(稀)=ZnSO4+H2↑
(1)可见所谓有杂质气体就是氢气
(2)为了检验氢气的存在,结合题目所给装置及药品可知:用氢气还原CuO(黑色粉末变红),生成的水用无水硫酸铜(装置D)来检验
先用碱液吸收SO2,再通过KMnO4溶液是否褪色来检验并再次吸收SO2;随后必须用浓硫酸干燥气体,得到干燥纯净的氢气,通入装置C中来还原CuO;
(3)设混合气体中SO2、H2的物质的量分别为x mol、y mol
由①②两方程式及题目所给数据可知,确定该混合气体(SO2、H2)的组成,已经知道混合气体的体积(标准状况下x+y=11.2/22.4=0.5),只要知道收集到气体的质量或浓硫酸的物质的量浓度均可再列出一等式,即可满足题意
64x+2y=25.8或2x+y=0.05×18
但知道反应后剩余锌粉的质量只能列出同样的等式,即:x+y=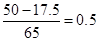 ,求不出未适量,排除A
,求不出未适量,排除A
故答案为BC
最终解得:x=0.4mol y=0.1mol
