钛(Ti)具有高强度和耐酸腐蚀性,是重要的工业原料。以金红石(主要成分为TiO2,含少量Fe2O3、SiO2)为原料可制取Ti。工业流程如下:

(1)粗TiCl4中含有少量FeCl3、SiCl4等,它们的部分性质如下:

从粗TiCl4中精制TiCl4的方法是________(填字母)。
A.用水溶解后,重结晶 B.蒸馏 C.用乙醚萃取后,分液
(2)写出用惰性电极电解熔融NaCl时阳极的电极反应式:_________________;阴极产物是__________。
(3)Ti可溶解在浓HF溶液中,请完成下列离子方程式:

(4)如图是一个制取氯气并以氯气为原料进行反应的装置,
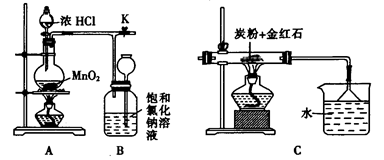
①装置A中发生反应的化学方程式为_____________________________________。
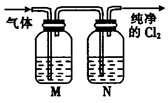
②在实验室中,某同学欲用如图所示装置净化氯气,则M、N中应盛放的试剂分别是__________、__________。(填试剂名称)
③实验开始时,先点燃A处的酒精灯,打开旋塞K,让C12充满整个装置,再点燃C处酒精灯。Cl2通过装置M、N再进入装置C,与装置C中的固体粉末发生氧化还原反应生成CO气体。试写出装置C中发生反应的化学方程式:_________________________。
(14分)
(1)B(3分)
(2)2Cl- -2e-= Cl2↑;钠(或Na)( 各2分)
(3)1,6.1.2H+,2(3分)
(4) ①4HCl(浓)+MnO2 MnCl2+Cl2↑+2H2O (2分)
MnCl2+Cl2↑+2H2O (2分)
②饱和食盐水;浓硫酸(各1分)
③TiO2+2C+2 Cl2 TiCl4 +2CO(2分)
TiCl4 +2CO(2分)
题目分析:
(1)结合杂质的性质,可以看出熔沸点相差较大,可采用蒸馏的方法;
(2)惰性电极电解熔融NaCl时阳极放电的Cl-,2Cl- -2e-= Cl2↑;阴极产物为钠。
(3)根据化合价变化情况可得:分别为1,6.1.2H+,2
(4)①实验室制取氯气的反应4HCl(浓)+MnO2 MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
②除去氯气中氯化氢用饱和食盐水,干燥可用浓硫酸。
③根据题意可得反应为:TiO2+2C+2 Cl2 TiCl4 +2CO
TiCl4 +2CO
