地球上99%的溴元素存在于海洋中,资料显示海水中溴含量约为66mg·L—1。从海水中提取溴的工业流程如下:
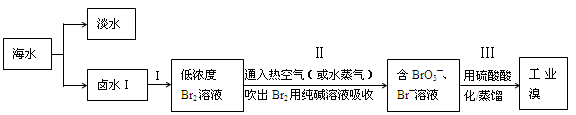
(1)写出海水淡化的一种方法: 。
(2)步骤Ⅱ通入热空气或水蒸气吹出Br2,利用到溴的性质是 。
(3)以上步骤I中已获得游离态的溴,步骤Ⅱ又将之转化成化合态的溴,其目的是
。
(4)上述流程中吹出的溴蒸气,也可以用二氧化硫水溶液吸收,再用氯气氧化后蒸馏。写出溴与二氧化硫水溶液反应的化学方程式: 。
(5)实验室从溴水中分离溴还可以用萃取法,下列可以用作溴的萃取剂的是
a.乙酸 b.四氯化碳 c.裂化汽油 d.苯
(6)假设提取过程中溴没有损失,计算1m3海水按上述流程进行实验时,步骤中Ⅱ约需消耗lmol·L—1Na2CO3溶液 L。
(11分)
(1)蒸馏法(或电渗析法或离子交换法) (1分)
(2)挥发性(1分)
(3)溴元素的富集(或浓缩溴元素) (2分)
(4)Br2+SO2+2H2O=2HBr+H2SO4 (2分)
(5)bd(2分) 、
(6)0.4125(3分)
题目分析:(2)Br2的沸点较低,热空气可以使Br2从水中挥发出来。(4)Br2可将SO2氧化为SO42-,本身被还原为Br-。(5)萃取剂的选择要求:要与原溶剂互不相溶,互不反应,且溶质在萃取剂中的溶解度要比在水中大得多。a项,乙酸与水互溶;b项,符合萃取剂的要求,有机层在下层;c项,裂化汽油中含有不饱和烃,可与溴发生加成反应,不可作为萃取剂;d项,符合萃取剂的要求,最后有机层在上层。(6)发生反应的离子方程式为3Br2+3CO32-=5Br-+BrO3-+3CO2,n(CO32-)=n(Br2) =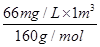 =0.4125mol,溶液体积V=0.4125L。
=0.4125mol,溶液体积V=0.4125L。
