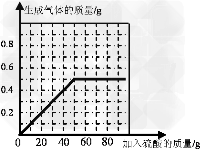
问题
计算题
为了测定某黄铜(铜锌合金)样品的组成,某化学兴趣小组的同学进行了以下实验:取四份相同质量的样品分别放入等质量的烧杯中,然后分别加入稀硫酸,充分反映后用天平称量,几率试验数据如下:
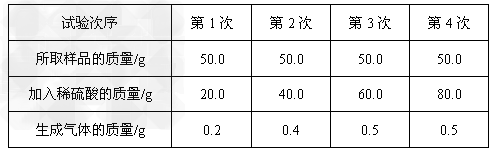
请回答下列问题并计算:
(1)经分析,在第1次实验结束后,反应物_________完全反应完了。
(2)50.0g样品与足量稀硫酸反应最多能生成气体_________g。
(3)计算样品中锌的质量分数(写出具体计算过程)。
(4)请在图中画出加入稀硫酸的质量与生成气体的质量的变化关系。

答案
(1)硫酸;
(2)0.5;
(3)解:设50g样品中锌的质量为x。
Zn+H2SO4=ZnSO4+H2↑
65 2
x 0.5g
65:x=2:0.5g
x=16.25g
样品中锌的质量分数为:16.25g/50g ×100%=32.5%。
答:样品中锌的质量分数为32.5%。
(4)加入稀硫酸的质量与生成气体的质量的变化关系图为: