某研究性学习小组用如下图装置进行铜与浓硫酸反应的实验研究。
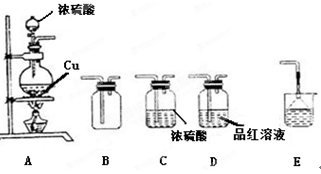
(1)装置A中发生反应的化学方程式 ;
(2)若要使B 中收集满干燥的SO2气体(并证实B中已收集满),则上述装置的连接顺序为: 接 接 接 接 (用字母表示)
(3)待烧瓶中充分反应后,同学们发现铜有剩余。经检测发现硫酸也有剩余.其原因是 ;
检验硫酸有剩余的方法是 .
(4)在不补充浓硫酸的前提下.为使铜进一步溶解,可向烧瓶中加入 (填序号)
①盐酸 ② FeSO4 ③ Fe2O3 ④KNO3

按正确的顺序连接装置:A―制SO2,C―干燥,B―收集SO2,D―检验SO2,E―吸收尾气。
⑴Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
⑵ACBDE
⑶稀硫酸与铜不反应,所以随反应的进行,硫酸浓度变稀,铜和硫酸都有剩余;取反应后的溶液,加入锌等活泼金属,有气泡产生,检验气体,有爆鸣声,说明硫酸有剩余。
⑷溶液中有H+,补充NO3―会发生3Cu+2NO3―+8H+=3Cu2++2NO+4H2O,选④,另外Cu也能被Fe3+氧化,③也行。