问题
计算题
某同学为测定12g含杂质的氧化铁样品中氧化铁的质量分数,利用稀硫酸和锌粒制取氢气,设计了下图所示的装置,进行有关的实验探究(提示:3H2+Fe2O3 2Fe+3H2O杂质不参加反应,假定每步均完全反应或吸收).请回答有关问题:
2Fe+3H2O杂质不参加反应,假定每步均完全反应或吸收).请回答有关问题:
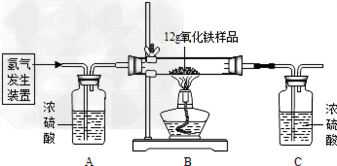
得到如下数据:
| 装置 | B | C |
| 反应前质量 | 86.3g | 284.2g |
| 反应后质量 | 83.9g | 286.9g |
(1)请计算样品中氧化铁的质量分数.(写出计算步骤,计算结果精确到0.1%)
答案
(1)样品中氧化铁的质量分数为66.7%.
(2)[(286.9g﹣284.2g)﹣(86.3g﹣83.9g)]:(86.3g﹣83.9g);不变;
