问题
计算题
2008年北京奥运圣火在珠穆朗玛峰成功传递,假如每名运动员冲顶时消耗自带的液氧4.8 kg。求:
(1)这些氧气在标准状况下的体积是多少升?(标准状况下氧气密度为1.43 g/L)
(2)若在实验室用高锰酸钾为原料制取相同质量的氧气,需要多少千克高锰酸钾?
(3)用这种方法给登山队员供氧,是否可行?简述理由。
答案
(1)4.8 kg氧气在标准状况下的体积为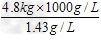 =3 356.61。
=3 356.61。
(2)解:设需要高锰酸钾的质量为x,则有
2KMnO4=K2MnO4+MnO2+O2↑
316 32
x 4.8 kg
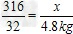 ,解得x=47.4 kg
,解得x=47.4 kg
答:需要高锰酸钾的质量为47.4 kg,
(3)不行。此法成本太高,经济上不合算(或在实验室制如此多氧气,耗时太长)。
