问题
计算题
黄铜是铜和锌合金。某化学兴趣小组的同学在测定黄铜样品中铜的含量时,取黄铜样品20g放入烧杯中,向其中加入100g稀硫酸,恰好完全反应。反应后烧杯中剩余物的总质量为119.8g。请计算:
(1)反应产生氢气的质量是 g。
(2)求黄铜样品中铜的质量分数。(写出计算过程)
答案
(1)0.2
(2)解:设黄铜样品中锌的质量为x
Zn + H2SO4 = ZnSO4 + H2↑
65 2
x 0.2g
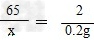
x=6.5g
(20g-6.5g)/20g×100%=67.5%
答:样品中铜的质量分数为67.5%。
