某校探究学习小组同学用含有少量杂质(主要为少量泥沙、CaCl2、MgCl2、Na2SO4等)的粗盐制取“化学纯”级的NaCl,实验前他们设计了如下方案(框图)。
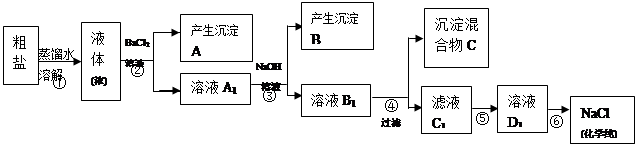
(1)请写出操作第④、⑤步所加试剂名称及第⑥步操作名称:④ ,⑤ ,⑥ ;
(2) 沉淀混合物C的化学成分有(用文字和化学式表示): ;
(3)写出第⑤步操作中可能发生反应的离子方程式:
;
(4)如何用最简单方法检验第⑤步实验是否达到了目的:
;
(5)你认为该设计里哪些步骤调换后不影响实验结果: ;
(6)有同学认为上述实验设计步骤可以简化,请你提出简化的一种设想:
。
⑴④碳酸钠溶液 ⑤盐酸 ⑥蒸发(蒸发结晶也可)(各1分)
⑵ 泥沙、BaSO4、BaCO3、CaCO3、Mg(OH)2(2分)
⑶第⑤步:H+ + OH- = H2O (1分) CO32- + 2H+ = H2O + CO2↑(1分)
⑷ 用玻璃棒蘸取溶液点在pH试纸中部,若变红,说明溶液呈酸性,无OH-、CO32-存在;若变蓝,说明溶液仍呈碱性,有OH-、CO32-存在,需继续滴加盐酸至呈酸性。(2分)
⑸②和③或③和④(2分)
⑹ 用Ba (OH)2代替BaCl2和NaOH,使②③步合并为一步(1分)
题目分析:(1)分析流程图已给出的试剂的作用,BaCl2溶液除去Na2SO4,NaOH溶液除去MgCl2,所以④的作用为除去CaCl2,所选试剂为Na2CO3溶液,⑤的作用是除去过量的NaOH、Na2CO3,应选用盐酸,⑥的作用是从NaCl溶液中得到化学纯NaCl,为蒸发操作。
(2)BaCl2、NaOH、Na2CO3反应后得到的沉淀共有:泥沙、BaSO4、BaCO3、CaCO3、Mg(OH)2。
(3)第⑤步加入HCl,与NaOH和Na2CO3反应,所以离子方程式为:H+ + OH- = H2O; CO32- + 2H+ = H2O + CO2↑。
(4)HCl足量时第⑤步达到了目的,可用pH试纸检验,若试纸变化,证明HCl过量,OH‾、CO32‾不存在,若变蓝,说明还有OH‾、CO32‾,需继续滴加盐酸至呈酸性。
(5)NaOH不影响其他物质的除去,所以NaOH的加入顺序可以提前,也可以向后调整,即②和③或③和④可调换。
(6)用Ba (OH)2代替BaCl2和NaOH,可同时除去Na2SO4和MgCl2,使②③步合并为一步。
