问题
计算题
黄铜是锌和铜的合金,可以用来制造机器零件及日常用品.为了测定某粉末状黄铜样品中锌的质量分数,取10g这种样品放入烧杯中,再将40g稀盐酸分四次加入到该烧杯中,均充分反应.测得的实验数据如下表:
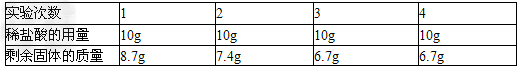
分析表中数据,完成下列问题:
(1)在第 ____次实验结束时样品中的锌就已完全反应.
(2)计算该黄铜样品中锌的质量分数.
(3)计算所用稀盐酸的溶质质量分数.
答案
(1)3
(2)由第三次和第四次剩余固体质量相等可知,剩余的6.7g固体即为样品中铜的质量,故锌的质量为样品质量减去铜的质量,即为10g﹣6.7g=3.3g,
故黄铜中锌的质量分数为: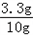 ×100%=33%;
×100%=33%;
答:该黄铜样品中锌的质量分数33%.
(3)根据金属活动性可知,铜排在氢后,不能与稀盐酸发生反应,故发生反应的是锌,减少的固体的质量就是参加反应的锌的质量,由题目可知:第二次反应消耗锌的质量=8.7g﹣7.4g=1.3g,设稀盐酸中溶质的质量为x
Zn+2HCl==ZnCl2+H2↑
65 73
1.3g x

x=1.46g
稀盐酸中溶质的质量分数为 ×100%=14.6%
×100%=14.6%
答:所用稀盐酸的质量分数为14.6%.
