问题
计算题
将65g KMnO4放入试管中加热制取O2,一段时间后,移开酒精灯,待试管冷却后称量试管中剩余固体总质量为58.6g,求:
(1)生成氧气的质量;
(2)参加反应的高锰酸钾的质量.
答案
(1)根据质量守恒定律,反应前固体KMnO4的质量65克,反应后剩余固体是K2MnO4、MnO2,其质量和为58.6g,两质量差即为氧气的质量.即生成氧气的质量为:65g﹣58.6g=6.4g;
(2)设参加反应的KMnO4的质量为xg.
2KMnO4 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
316 32
x g 6.4g
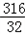 =
=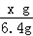
解得 x=63.2
答:
(1)生成氧气的质量为6.4g;
(2)参加反应的高锰酸钾的质量为63.2g.
