(15分)某校化学兴趣小组为探究SO2气体的还原性设计了如下装置图:
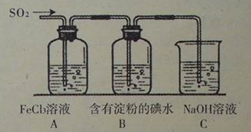
(1)SO2气体还原Fe3+的离子反应方程式为 ;
(2)实验中所需的SO2气体可以用浓硫酸和铜反应来制取,该反应的化学方程式为
,在反应表现了H2SO4的哪些性质 。
(3)装置C的作用是 。
(4)若要从A中得到溶液提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、过滤、自然干燥,在这一系列操作中没有用到的仪器有 (填字母序号)。
A.蒸发皿
B.石棉网
C.漏斗
D.烧杯 E.玻璃棒 F.坩埚
(5)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,不变红,紫色褪去。
方案②:往第二份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
方案③:往第三份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀
上述方案不合理的一个方案 (填数字序号),原因是 。
(6)上述装置中能表明I-的还原性弱于SO2的现象是 。
(15分)(1)SO2+2Fe3++2H2O SO42-+2Fe2++4H+(2分);
SO42-+2Fe2++4H+(2分);
(2)Cu+2H2SO4(浓)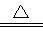 CuSO4+2H2O+SO2↑(2分);酸性和氧化性(2分);
CuSO4+2H2O+SO2↑(2分);酸性和氧化性(2分);
(3)吸收SO2尾气,防止污染空气(2分);
(4)BF(2分);
(5)①(1分);因为A的溶液中含有SO2,SO2也能使KMnO4溶液褪色(2分);
(6)B中蓝色溶液褪色(2分)。
本题为SO2的性质综合实验,二氧化硫是酸性氧化物,具有其通性,S为+4价,既有氧化性又有还原性,更多时候体现出还原性。(5)方案一中,SO2和Fe2+,都能是酸性高锰酸钾褪色,故不能确定是否发生反应。(6)氧化性、还原性的强弱,我们一般是看在同一氧化还原反应中,氧化剂的氧化性大于氧化产物,还原剂的还原性大于还原产物,故I2把SO2氧化,故SO2的还原性强于I-。
