研究小组欲进行从海水中获取淡水、食盐并提取镁和溴等物质的实验探究。
(1)无需经过化学变化就能从海水中获得的一组物质是 (填序号)。
① Cl2、Br2、I2 ② Na、Mg、Al ③烧碱、氢气 ④食盐、淡水
(2)在生产过程中,从海水中提取镁的流程如下图所示:
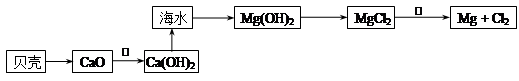
贝壳中的主要成分是:___________(填化学式);反应①属于________反应(填“吸热”或“放热”)。
反应②的化学方程式为 。
(3)实验室从海水样品中提取溴的主要步骤是:向海水样品中通入适量氯气将溴离子氧化,该反应的离子方程式为 ;从反应后的溶液中提取溴单质的实验操作是____________(填实验操作名称)。
(1)④(1分);
(2)CaCO3(1分); 放热(1分); MgCl2(熔融态) Mg+Cl2↑ (2分);
Mg+Cl2↑ (2分);
(3)Cl2+2Br-=2Cl-+Br2(2分);萃取(1分)
题目分析:(1)①从海水中提炼溴和碘,是用氯气把其中的碘离子和溴离子氧化为碘单质和溴单质,是化学变化,同样要得到氯气,需要电解熔融的氯化钠,也是化学变化,①不正确;②要从海水中得到钠、镁,需要首先从海水中获得氯化钠和氯化镁,然后再去电解熔融状态的氯化钠和氯化镁,得钠和镁,是化学变化,故②错误;③电解饱和食盐水,得到烧碱、氢气和氯气,是化学变化,故③错误;④氯化钠在海水中的浓度很大,用蒸馏等方法可以从海水中得到淡水,海水经太阳暴晒,蒸发水分后即得食盐,不需要化学变化就能够从海水中获得。同样经过蒸馏也可以得到淡水,属于物理变化,故④正确,答案选④。
(2)贝壳中的主要成分是碳酸钙,碳酸钙高温分解生成氧化钙和CO2。氧化钙溶于水得到氢氧化钙,该反应是放热反应;氢氧化钙与海水混合生成氢氧化镁白色沉淀,氢氧化镁内盐酸溶解生成氯化镁。镁是活泼的金属,要冶炼金属镁,需要电解熔融的氯化镁即得到镁和氯气,反应的化学方程式为MgCl2(熔融态) Mg+Cl2↑。
Mg+Cl2↑。
(3)氯气的氧化性强于单质溴的,因此氯气能氧化溴离子生成单质溴,反应的离子方程式为Cl2+2Br-=2Cl-+Br2;由于单质溴易溶在有机溶剂中,因此从反应后的溶液中提取溴单质的实验操作是萃取。
