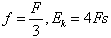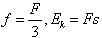六个未贴标签的试剂瓶中分别装有以下稀溶液①FeSO4、②H2SO4、③BaCl2、④H2O2、⑤Al(NO3)3、⑥NaOH。
(1)某同学想不用其它试剂,仅通过用试管取少量上述溶液进行两两混合实验而给试剂瓶贴上正确的标签,她能成功吗? (填“能”或“不能”)。
(2)实验中发现,有一组在混合时,随着试剂滴加的顺序不同而出现明显不同的现象,该组是 ,有一组在混合时.随着试剂滴加后的时间不同而出现明显不同的现象,该组是为 ,该组涉及氧化还原应的化学方程式 。
(3)鉴别后,该同学又用FeSO4做了三个体现Fe2+还原性的实验,每次加入上述两种已鉴别的物质的溶液与其混合。试写出其中两个反应的离子方程式
(4)以下各种溶液不用任何外加试剂,就能实现鉴别的是
①Al(NO3)3 FeCl3 NaOH FeSO4 NaHCO3
②Na2CO3 BaCl2 AgNO3 Na2SO4 NH3·H2O
③KOH NaCl NaHCO3 MgSO4 KNO3
④CuSO4 KHSO4 NaHCO3 KOH
⑤NaAlO2 Na2SiO3 Na2CO3 NaHSO4 NaCl
⑥NH4Cl Na2SO4 (NH4)2SO4 Ba(OH)2 AlCl3
(1)能(1分)(2)⑤和⑥(1分) ①和⑥(1分)4Fe(OH)2+O2+2H2O=4Fe(OH)3(3)①②⑤:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O;①②④:2Fe2++2H++H2O2=2Fe3++2H2O
①④⑥:2Fe2++2HO-+H2O2=2Fe(OH)3(三个选两个,每个2分,共4分)
(4)①④⑤⑥(4分,每个1分,错选一个扣1分,不出现负分)
题目分析:(1)由于FeSO4溶液显浅绿色,因此首先鉴别出硫酸亚铁。硫酸亚铁与氯化钡反应生成白色沉淀硫酸钡,则可以鉴别出氯化钡。硫酸亚铁具有还原性,能和双氧水反应生成硫酸铁,溶液由浅绿色变为棕黄色,故可以鉴别出双氧水。硫酸亚铁能和氢氧化钠反应生成白色沉淀氢氧化亚铁,如何迅速变为灰绿色,最终变为红褐色氢氧化铁,故可以鉴别出氢氧化钠。利用氢氧化钠可以鉴别硝酸铝,因为二者反应生成白色沉淀氢氧化铝,氢氧化钠过量,白色沉淀又溶解,因此可以成功。
(2)由于氢氧化铝是两性氢氧化物,所以氢氧化钠滴入硝酸铝溶液中得到白色沉淀氢氧化铝,氢氧化钠过量,白色沉淀又溶解。如果硝酸铝滴入氢氧化钠溶液中开始达不到白色沉淀,当硝酸铝过量时开始出现白色沉淀氢氧化铝,故实验现象不同,答案选⑤和⑥。
(3)由于在酸性条NO3-具有强氧化性,能氧化Fe2+,所以可以选择①②⑤,有关反应的离子方程式为3Fe2++4H++NO3-=3Fe3++NO↑+2H2O;又因为双氧水也具有氧化性,也能氧化Fe2+,所以可以选择①②④或①④⑥,有关反应的离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O或2Fe2++2HO-+H2O2=2Fe(OH)3。
(4)①、铁离子在溶液中显棕黄色,亚铁离子显浅绿色,据此可以鉴别出氯化铁和硫酸化亚铁。利用氯化铁与氢氧化钠反应生成红褐色沉淀可以鉴别氢氧化钠。氯化铁与碳酸氢钠溶液混合生成红褐色沉淀并产生CO2气体,可以鉴别碳酸氢钠。利用氢氧化钠和硝酸铝反应生成白色沉淀氢氧化铝可以可变硝酸铝,所以①正确;②、硝酸银与另外四种物质均反应生成白色沉淀,因此可以鉴别出硝酸银。由于氢氧化银能溶解在氨水中,因此可以鉴别出氨水。由于氯化钡与碳酸钠以及硫酸钠均反应生成白色沉淀,所以不能据此碳酸钠和硫酸钠,②不正确;③、该组物质只有氢氧化钾与硫酸镁反应生成白色沉淀,其余两两混合要么不反应,要么反应但无明显实验现象,所以不能鉴别,③不正确;④、硫酸铜在溶液中显蓝色,可以鉴别。硫酸铜与氢氧化钾反应生成蓝色沉淀氢氧化铜,故可以鉴别氢氧化钾。向生成的氢氧化铜中加入硫酸氢钠可以溶解氢氧化铜,而碳酸氢纳不能溶解氢氧化铜,所以可以鉴别,④正确;⑤、硫酸氢钠与偏铝酸钠反应生成白色沉淀,硫酸氢钠过量沉淀又溶解,可以鉴别偏铝酸钠。硫酸氢钠与硅酸钠反应生成硅酸白色沉淀,可以鉴别。硫酸氢钠与碳酸钠反应生成CO2气体可以鉴别。硫酸氢钠与氯化钠不反应,可以鉴别,⑤正确;⑥、氢氧化钡与氯化铵反应生成氨气,与硫酸钠反应生成白色沉淀硫酸钡,与硫酸铵反应生成氨气和白色沉淀硫酸钡,与氯化铝反应生成白色沉淀氢氧化铝,氢氧化钡过量氢氧化铝又溶解,实验现象各不相同,可以鉴别,⑥正确,答案选①④⑤⑥。