实验室中现有一种铜合金样品,已知此样品为铜锌合金、铜铝合金、铜银合金和铜铁合金中的一种,为确定其为四种合金中的哪一种,实验小组的同学们进行了下列的实验,请回答下列问题:
(1)实验室中有贴有如图所示标签的浓硫酸,要配制20%的稀硫酸350克,需该浓硫酸的体积是 _________ mL;
(2)将20g合金粉末加入到98g新配好的稀硫酸中,恰好完全反应.过滤,将滤液蒸干后得到固体纯净物32.2g.通过计算回答:
①此合金为_________;
②写出发生反应的化学方程式:_________
③根据已知条件写出求解生成气体质量(x)的比例式: _________
④若向反应后所得滤液中加入89.4g水,则最终所得溶液中的溶质质量分数为 _________ .
(3)若工业上用含Cu2S70%的辉铜矿100t炼铜,并将其冶炼成上述铜的合金,(假设炼制过程中辉铜矿的损失率为10%),能炼出此铜合金的质量为 _________ .

(1)100;
(2)①铜锌;
②Zn+H2SO4==ZnSO4+H2↑;
③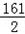 =
=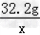 ;
;
④16.1%;
(4)含Cu2S70%的辉铜矿100t可炼出铜的质量=100t×(1﹣10%)×70%×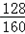 ×100%=50.4t
×100%=50.4t
铜锌合金中铜的质量分数=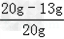 ×100%=35%
×100%=35%
能炼出此铜合金的质量=50.4t×35%=144t

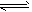 PCl3(g)+Cl2(g)(正反应吸热)达到平衡后,下列情况使PCl5分解率降低的是[ ]
PCl3(g)+Cl2(g)(正反应吸热)达到平衡后,下列情况使PCl5分解率降低的是[ ]