问题
计算题
黄铜(由铜和锌形成的合金)有较强的耐磨性能、可塑性好、易加工,在生活中有广泛的用途,可以制作机器零件、仪表等.某同学为了测定某黄铜屑样品的组成,分四组取样品与稀硫酸反应,其实验数据记录如下表:
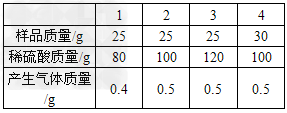
计算:
(1)通过分析上述数据可知,当黄铜样品和稀硫酸的质量比为多少时 时,两者恰好完全反应?
(2)求黄铜合金中铜的质量分数?
(3)求所用稀硫酸中硫酸的质量分数?
答案
(1)从四次反应的数据可知第二次正好完全反应,当黄铜样品和稀硫酸的质量比为1:4时,两者恰好完全反应;
(2)设25g样品中心的质量为x,100g稀硫酸中溶质的质量为y.
Zn+H2SO4=ZnSO4+H2↑
65 98 2
x y 0.5g
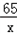
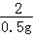 ,解得x=16.25g
,解得x=16.25g
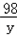 =
=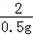 ,解得y=24.5g
,解得y=24.5g
25g黄铜中铜的质量为25g﹣16.25g=8.75g
黄铜合金中铜的质量分数为: =35%
=35%
答:黄铜合金中铜的质量分数为35%.
(3)稀硫酸中溶质质量分数为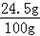 ×100%=24.5%
×100%=24.5%
答:所用稀硫酸中硫酸的质量分数为24.5%
