富马酸亚铁(分子式为C4H2O4Fe,结构简式为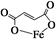 )是一种限量使用的铁强化剂。
)是一种限量使用的铁强化剂。
(1)下图为实验室模拟工业制取富马酸亚铁的流程图:
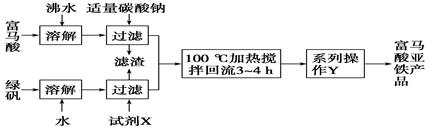
①根据题意,请你写出富马酸的结构简式:________________________。
②绿矾(FeSO4·7H2O)在保存过程中形成的杂质主要有________(填化学式)。
③操作Y包括________、冷却结晶、过滤、洗涤、干燥等。
④判断操作Y中“洗涤”富马酸亚铁产品表明已洗净的实验方法是___________。
(2)设计一个实验方案,证明所得富马酸亚铁产品属于亚铁盐(可供选用的试剂有KSCN溶液、H2O2溶液、稀硫酸。)。填写下表相应空格:
| 步骤 | 实验操作与现象 |
| ① | 取富马酸亚铁产品1.5 g,加入稀硫酸25 mL,用水稀释至50 mL,加热使其完全溶解并反应,冷却后过滤(除去生成的富马酸及可能过量的反应物),保存滤液 |
| ② | |
| ③ |
(1)①HOOCHC===CHCOOH
②Fe2(SO4)3和Fe(OH)3
③蒸发浓缩
④取洗涤液,向其中加入少量盐酸酸化后再加入氯化钡溶液,无白色沉淀生成
(2)②取少量滤液,滴加KSCN溶液,不显血红色
③再向上述溶液中滴加H2O2溶液,溶液显血红色
题目分析:(1)①由富马酸亚铁的结构简式可推断富马酸的结构简式为HOOCHC===CHCOOH,②由于亚铁离子不稳定,容易被氧化成三价铁离子,铁离子在溶液中会发生水解,生成氢氧化铁,所以绿矾(FeSO4•7H20)在保存过程中形成的杂质主要有硫酸铁、氢氧化铁等杂质③得到的含有富马酸亚铁的溶液需要经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥等操作,最后得到富马酸亚铁产品;④富马酸亚铁表面的可溶性杂质离子有Na+、SO42-等,可以从检验洗涤液中是否含Na+或SO42-来设计实验.所以检验方法是:取最后一次洗涤液,先加入稀盐酸,再加入氯化钡溶液,无白色沉淀生成,说明已洗涤干净.
(2)检验亚铁离子的方法:滴加硫氰化钾溶液,溶液没有变成红色,证明溶液中没有三价铁离子;然后加入氧化剂将亚铁离子氧化成三价铁离子,溶液变成红色,证明原溶液中存在亚铁离子,结合题给试剂故答案为:
| 步骤 | 实验操作与现象 |
| ① | 取富马酸亚铁产品1.5 g,加入稀硫酸25 mL,用水稀释至50 mL,加热使其完全溶解并反应,冷却后过滤(除去生成的富马酸及可能过量的反应物),保存滤液 |
| ② | 取少量滤液,滴加KSCN溶液,不显血红色 |
| ③ | 再向上述溶液中滴加H2O2溶液,溶液显血红色 |
