(14分)已知:①FeS不溶解于水;②实验室制取H2S、SO2气体的原理是:
FeS+H2SO4=FeSO4+H2S↑ Na2SO3+H2SO4=Na2SO4+H2O+SO2↑
③硫化氢与二氧化硫气体相遇会发生反应:2H2S+SO2=3S+2H2O
根据下图中A~D的实验装置和试剂进行实验,回答下列问题:
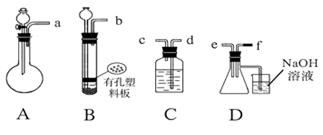
⑴装置A是由双孔塞、玻璃导管及 和 组装起来的
⑵组装一套制取SO2气体的装置,并证明SO2既有氧化性、又有还原性和漂白性
①按实验装置连接顺序,把a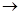 f各导管口连接起来,正确的顺序有
f各导管口连接起来,正确的顺序有
A.befcda
B.adcefb
C.acdfeb
D.acdefb②若C装置中的溶液为 ,反应后该溶液变为无色,说明SO2具有还原性;
③若C装置中的溶液为 ,反应后该溶液变为无色,说明SO2具有漂白性;
④当D中产生 现象时,说明SO2具有氧化性;
(3)D装置烧杯中NaOH溶液的作用 。
(14分)
⑴ 分液漏斗、圆底烧瓶
⑵ ① AB ②酸性KMnO4溶液或溴水、碘水等
③ 品红溶液 ④有淡黄色固体析出
(3) 吸收未反应的H2S或SO2气体,以免污染空气
本题考查了气体的实验室制取、硫的化合物的相关性质
首先,FeS不溶解于水,而Na2SO3可溶于水,所以制取H2S的装置用B,而制SO2的装置为A;
第二,为了证明SO2的氧化性,应该在D装置的锥形瓶中混合两气体;为了证明其还原性,可以C试剂瓶中注放氧化剂,例如酸性KMnO4溶液或溴水等;为了证明其漂白性,可在C装置中加入品红溶液来检验。
第三,很明显D装置中的碱溶液起到尾气吸收的作用。
