取氯酸钾与二氧化锰的混合物30g放在大试管中加热,过一段时间后,停止加热,冷却,称得剩余固体的质量为26.16g,然后继续加热,至不再有气体放出为止,第二次收集到的氧气为5.76g,求:
(1)共收集到O2多少克?
(2)原混合物中有多少克MnO2?
(3)第一次加热后,有多少克KClO3分解了?
(4)第一次加热后剩余的26.16g固体中含有几种物质?各多少克?
(1)根据固体质量的减少量就是生成氧气的质量,所以第一次加热后生成氧气质量为:30g﹣26.16g=3.84g,所以共收集到氧气:3.84g+5.76g=9.6g;
(2)设要生成9.6g氧气需要参加反应的氯酸钾的质量为X则:
2KClO3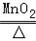 2KCl+3O2↑
2KCl+3O2↑
245 96
X 9.6g
根据: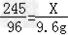 ,解得X=24.5g,
,解得X=24.5g,
所以原混合物中MnO2质量为:30g﹣24.5g=5.5g;
(3)根据题意可知第一次产生氧气质量为3.84g,设要生成3.84g氧气需要分解氯酸钾的质量为Y,同时生成氯化钾的质量为Z则:
2KClO3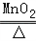 2KCl+3O2↑
2KCl+3O2↑
245 149 96
Y Z 3.84g
根据: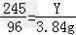 ,解得Y=9.8g,根据:
,解得Y=9.8g,根据: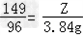 ,解得Z=5.96g;
,解得Z=5.96g;
所以第一次加热后,分解的氯酸钾质量为9.8g;
(4)第一次加热后剩余的26.16g固体中含有二氧化锰,质量不变还是5.5g,还含有生成的氯化钾5.96g,还含有没反应的氯酸钾:26.16g﹣5.5g﹣5.96g=14.7g.
