某中学社会实践活动小组利用假期对当地钢铁厂进行了调研,对从矿石开始到钢铁产出的工艺流程有了全面的感性认识.请你回答下列社会实践活动小组感兴趣的问题:
(1)将6.62g铁矿石样品投入适量的盐酸中(充分反应),过滤,然后在滤液中加过量的NaOH溶液,充分反应后,过滤、洗涤、灼烧得4.80g Fe2O3.现以该铁矿石为原料炼铁,若生产过程中铁元素损失4%,计算每生产1.00t生铁(含铁96%),至少需要这种铁矿石多少吨?(保留两位小数)
(2)取某钢样粉末28.12g(假设只含Fe和C),在氧气流中充分反应,将产生的气体通入足量的澄清石灰水中,得到1g白色沉淀.
①计算此钢样粉末中铁和碳的质量之比.
②再取三份不同质量的钢样粉末分别加到50g质量分数相同的稀H2SO4中,充分反应后,测得的实验数据如下表所示:(标准状况下,2gH2的体积为22.4L)
请根据表中数据计算稀硫酸中H2SO4的质量分数.

(1)解:6.62g铁矿石中铁的质量为mFe=4.80×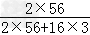 =3.36g
=3.36g
生产1.00t生铁需铁矿石的质量为:m铁矿石= ×1.97t
×1.97t
答:至少需要这种铁矿石1.97t
(2)①根据题意知,该白色沉淀是CaCO3,所以C的质量=0.12g;
故此钢样粉末中铁的质量=28.12g﹣0.12g=28g;
所以此钢样粉末中铁和碳的质量之比=28:0.12=700:3;
答:此钢样粉末中铁和碳的质量之比为700:3;
②设50g稀硫酸中溶质的质量为x
Fe+H2SO4=FeSO4+H2↑
98 2
x 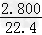 ×2g
×2g
 =
=
x=12.25g
稀硫酸中H2SO4的质量分数为: ×100%=24.5%,
×100%=24.5%,
答:稀硫酸中H2SO4的质量分数为24.5%.
