某工厂排出的污水中含有大量的Fe2+、Zn2+、Hg2+三种金属离子。以下是某化学研究性学习小组的同学设计的除去污水中的金属离子,回收绿矾、皓矾(ZnSO4·7H2O)和汞的方案。
[药品] NaOH溶液、硫化钠溶液、硫化亚铁、稀硫酸、铁粉
[实验方案]
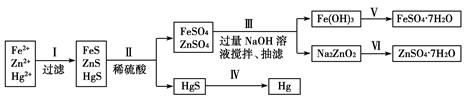
[问题探究]
(1)步骤Ⅱ所发生反应的离子方程式为_________________________________________________。
(2)步骤Ⅲ中的抽滤为减压条件下的过滤,可以加快过滤速度;该步骤涉及反应的离子方程式有Zn2++4OH-=ZnO22-+2H2O和________________。
(3)步骤Ⅵ中得到硫酸锌溶液的离子反应方程式为______________________________。
(4)欲实现步骤Ⅴ,所需加入的试剂有________、________,所涉及的主要操作依次为______________________。
(5)步骤Ⅳ常用的方法是加热,该步骤是否对环境有影响?__________(填“是”或“否”),如有影响,请你设计一个环境保护方案来实现步骤Ⅳ的反应________________________。
(1)FeS+2H+=Fe2++H2S↑,ZnS+2H+=Zn2++H2S↑
(2)4Fe2++O2+8OH-+2H2O=4Fe(OH)3↓
(3)ZnO22-+4H+=Zn2++2H2O
(4)稀硫酸 铁粉 过滤、浓缩结晶、过滤
(5) 是 在密闭容器中加热HgS
题目分析:(1)步骤Ⅱ加入稀硫酸,与FeS、ZnS分别发生复分解反应,可写成离子方程式。
(2)FeSO4、ZnSO4混合溶液中加入过量的NaOH时,Fe2+与OH-反应生成Fe(OH)2,Fe(OH)2迅速被空气中的O2氧化为Fe(OH)3,其总反应的离子方程式为:4Fe2++O2+8OH-+2H2O=4Fe(OH)3↓。
(3)根据框图转化关系,可以看出Zn(OH)2的性质类似于Al(OH)3,所以Na2ZnO2溶液中加入过量的H2SO4生成ZnSO4溶液,其离子方程式为:ZnO22-+4H+=Zn2++2H2O。
(4)氢氧化铁能与稀硫酸反应生成硫酸铁,硫酸铁能与过量铁单质反应生成二价铁离子,然后过滤、浓缩结晶、过滤得到FeSO4•7H2O。
(5)HgS在空气中加热可得Hg、SO2,Hg蒸气和SO2都会对环境产生污染,但在密闭容器中加热HgS可有效防止Hg蒸气和SO2释放到大气中,从而保护了环境。
