问题
计算题
某工厂利用废硫酸和废铁屑起反应来制取硫酸亚铁.现有废硫酸9.8t(H2SO4的质量分数为10%)与足量的铁屑起反应,理论上可生产FeSO4的质量是多少?
答案
解:消耗硫酸的质量为:9.8t×10%=0.98t,
设0.98t硫酸与铁反应生成硫酸亚铁的质量为X.
Fe+H2SO4═FeSO4+H2↑
98 152
0.98t X
根据: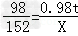 解得X=1.52t.
解得X=1.52t.
答:理论上可生产FeSO4的质量是1.52t.
