(12分)某同学为了检验浓硫酸与木炭粉在加热条件下反应产生的所有气体产物,选用了下图所示实验装置。

(1)写出浓硫酸和木炭粉在加热条件下发生反应的化学方程式
___________________________________________________。
(2)①中无水硫酸铜的作用是 。
(3)②中酸性KMnO4溶液的作用是______________________。
(4)②中两次用到品红溶液,它们的作用分别是A 、B 。
(5)③中发生反应的离子方程式是 。
(12分,每空2分)(1) C+ 2H2SO4(浓)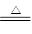 CO2↑+ 2SO2↑+ 2H2O
CO2↑+ 2SO2↑+ 2H2O
(2)检验反应生成的水蒸气 (3)除去混合气体中的SO2
(4)检验生成的SO2气体;检验SO2是否除尽
(5)CO2 + Ca2+ + 2OH- = CaCO3↓+ H2O
(1)浓硫酸具有强氧化性,能和氧化碳,方程式是C+ 2H2SO4(浓)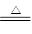 CO2↑+ 2SO2↑+ 2H2O。
CO2↑+ 2SO2↑+ 2H2O。
(2)无水硫酸铜易结合水蒸气,固体变成蓝色,用来经验水蒸气的存在。
(3)酸性高锰酸钾溶液具有氧化性,能氧化SO2,因此酸性高锰酸钾溶液的作用是除去混合气体中的SO2,以防止干扰CO2的检验。
(4)SO2具有漂白性,能使品红溶液褪色,所以第一次使用品红溶液是检验生成的SO2气体;而第二次使用品红溶液,则是检验SO2是否除尽的。
(5)CO2能使澄清的石灰水变混浊,反应的方程式是CO2 + Ca2+ + 2OH- = CaCO3↓+ H2O。
