(14分)某研究性学习小组为研究Cu与浓H2SO4的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出)。
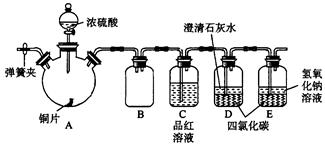
实验选用铜片、98.3%的H2SO4、品红溶液、澄清石灰水、CCl4、NaOH溶液等药品,铜片一端没入浓H2SO4中,另一端露置在液面上方。
回答下列问题。
(1)Cu与浓H2SO4的反应的化学方程式为____________________。
(2)D、E两容器中CCl4的作用是____________________。
(3)加热过程中,观察到A容器中出现大量白色烟雾,随着反应的进行,A容器下有白色沉淀生成,你认为该沉淀物是_________,分析可能的原因是________________________________________。
(4)对A容器中的浓H2SO4和铜片进行加热,很快发现C容器中品红溶液褪色,但始终未见D试管中澄清石灰水出现浑浊或沉淀。你的猜想是_________________________________________,设计实验验证你的猜想_______________________________________。
(5)实验结束后,为了减少环境污染,排除各装置中的SO2,可采取的操作是________________________________________________________。
(1) Cu+2H2SO4(浓)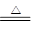 CuSO4+SO2↑+H2O(2分) (2)防止倒吸(2分)
CuSO4+SO2↑+H2O(2分) (2)防止倒吸(2分)
(3)CuSO4(2分),浓硫酸中含水少,生成的硫酸铜较多,浓硫酸的吸水作用(2分)
(4)由于SO2溶解度较大,澄清石灰水中Ca(OH)2含量低,生成了Ca(HSO3)2溶液的缘故(2分);取样后,向其中加入氢氧化钠溶液,观察是否有沉淀生成(2分)(或者加热、加盐酸检验SO2气体等方法)
(5)打开A容器上的弹簧夹,向里通入空气,将装置中的SO2赶到E中,最后再在B中加入NaOH溶液盖上塞子,振荡即可(2分)(注:直接在A中加NaOH溶液不给分)
(1)浓硫酸具有强氧化性,和铜的反应的方程式是Cu+2H2SO4(浓)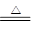 CuSO4+SO2↑+H2O。
CuSO4+SO2↑+H2O。
(2)由于SO2易溶于水,如果直接通入SO2,容易引起倒吸。而SO2不溶于四氯化碳,且四氯化碳不溶于水,密度大于水,所以四氯化碳的作用就是防止倒吸。
(3)由于浓硫酸中含有的溶剂水很少,而生成的硫酸铜较多,且浓硫酸具有吸水性,所以会有硫酸铜晶体析出。
(4)由于SO2溶解度较大,澄清石灰水中Ca(OH)2含量低,因此SO2是过量的,所以不能生成硫酸钙沉淀,而是生成了可溶性的Ca(HSO3)2,因此溶于不变混浊。由于Ca(HSO3)2能和强碱反应生成沉淀,据此可以鉴别。或者利用Ca(HSO3)2和盐酸反应生成SO2来检验。即取样后,向其中加入氢氧化钠溶液,观察是否有沉淀生成(或者加热、加盐酸检验SO2气体等方法)。
(5)由于装置中会残留没有挥发出的SO2,所以正确的做法是打开A容器上的弹簧夹,向里通入空气,将装置中的SO2赶到E中,最后再在B中加入NaOH溶液盖上塞子,振荡即可。