有一黑紫色的固体为KMnO4和MnO2的混合物,为测定混合物中KMnO4的质量分数,某同学取样35.0g,对固体充分加热,测得固体质量随反应时间变化的曲线如下图.
(1)生成氧气的总质量为______g(精确到小数点后一位).
(2)该混合物中KMnO4的质量分数为多少?(精确到0.1%)(要求写计算过程)
|(3)请在坐标图中画出MnO2固体的质量与反应时间的关系曲线.
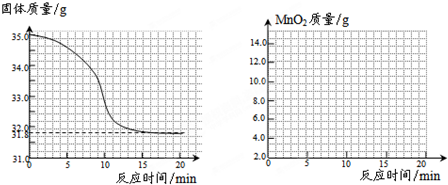
(1)根据质量守恒定律得知,生成的氧气的质量为:35g-31.8g=3.2g;
故答案为:3.2.
(2)设参与反应的高锰酸钾的质量为x,生成二氧化锰质量为y则:
2KMnO4
K2MnO4+MnO2+O2↑ △ .
316 87 32
x y 3.2g
根据:
=316 32
解得:x=31.6g,根据:x 3.2g
=87 32
,解得y=8.7g.y 3.2g
样品中高锰酸钾的质量分数是
×100%=90.3%31.6g 35g
(3)35g样品中KMn04的质量为31.6g,
则样品中MnO2的质量为35g-31.6g=3.4g;
生成的二氧化锰的质量为8.7g;
则MnO2的总质量为:3.4g+8.7g=12.1g;
故二氧化锰的质量从8.7g开始会慢慢的增多,直到第15分钟时高锰酸钾全部反应,此时二氧化锰的质量达到最大值;以后二氧化锰的质量将不再变化.
故答案为:
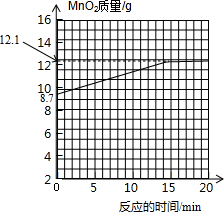
故答案为:(1)3.2;(2)90.3%;(3)

