(14分)某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。
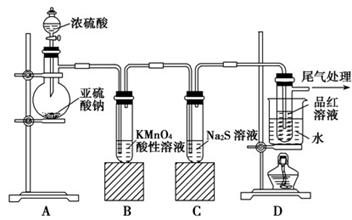
请回答下列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是________。
(2)实验过程中,装置B中产生的现象是________________________,这个现象说明SO2具有的性质是________________。
(3)装置C中Na2S溶液在空气中不易保存,时间长了会变浑浊,原因是(用离子方程式表示) __________________________________。
(4)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象__________________________________。
(5)如果把分液漏斗中的中的浓H2SO4换作浓HNO3,对此实验是否有影响
________(填“是”或“否” ),请说明你的理由_____________________________
(6)工业上用黄铜矿( CuFeS2)冶炼铜,副产品中也有SO2 ,冶炼铜的反应为
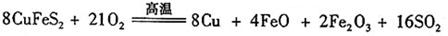
若CuFeS2中 Fe 的化合价为+2 ,反应中被还原的元素是 (填元素符号)。当生成0.8 mol铜时,此反应转移的电子数目是___________________。
(1)蒸馏烧瓶(1分) (2) 溶液颜色由紫色逐渐退去 还原性(每空1分,计2分)
(3) 2S2-+O2+2 H2O ===2 S↓+4 OH-(2分)
(4)品红溶液褪色后,关闭分液漏斗的旋塞,点燃酒精灯加热,溶液恢复为红色(2分)
(5)是(1分)浓HNO3可将亚硫酸钠氧化为硫酸钠,而得不到SO2气体(2分)
(6) Cu 、O(2分)(只写一个不得分) 10NA或6.02×1024(2分)
(1)根据仪器的构造可判断,该仪器是蒸馏烧瓶。
(2)A中产生SO2,由于SO2具有还原性,而酸性高锰酸钾溶液具有氧化性,所以B中溶液颜色由紫色逐渐退去。
(3)硫化钠中硫元素的化合价是最低价-2价,具有还原性,极易被氧化,生成单质硫,方程式为2S2-+O2+2 H2O ===2 S↓+4 OH-。
(4)SO2的漂白性原理是和有色物质结合,生成不稳定的无色物质。在加热的条件下,又能恢复原来的颜色,据此可以检验。即品红溶液褪色后,关闭分液漏斗的旋塞,点燃酒精灯加热,溶液恢复为红色。
(5)由于浓硝酸具有强氧化性,浓HNO3可将亚硫酸钠氧化为硫酸钠,而得不到SO2气体,因此对实验造成影响。
(6)CuFeS2中 Fe 的化合价为+2 ,则Cu的化合价是+2价,S的化合价是-2价。在生成物中Cu的化合价是0价,得到电子,被还原。同时氧气也是氧化剂,氧元素被还原;当生成0.8 mol铜时,被还原的铜是0.8mol,氧气是2.1mol,所以转移电子是0.8mol×2+2.1mol×4=10mol,即转移电子的个数是10NA或6.02×1024。
