NiSO4·6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有:Cu、Zn、Fe、Cr等杂质)为原料获得。操作步骤如下:
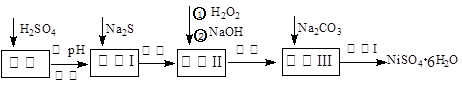
(1)加Na2S的目的是除去铜、锌等杂质,请写出除去Cu2+的离子方程式__________ __________
(2) 加6%的H2O2时,温度不能过高,是因为: _____ ________ 。
(3) 除铁方法:用H2O2充分氧化后,再用NaOH控制pH值3~4范围内生成氢氧化铁沉淀。在上述方法中,氧化剂可用NaClO3代替,请写出用氯酸钠氧化Fe2+的离子方程式为:___________________________________________________________________________
(4)上述流程中滤液Ⅲ的主要成分是: 。(填化学式)
(5)操作Ⅰ包括以下过程:过滤,用 (填试剂化学式)溶解, ,洗涤获得产品。
(1)S2-+Cu2+= CuS↓ (2)减少过氧化氢的分解,保证有一定的反应速率
(3)6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O
(4)Na2SO4、NiSO4 (5)H2SO4;蒸发浓缩、冷却结晶,过滤
题目分析:化工流程一般为酸溶、除杂、提纯三步。(1)加Na2S,易生成CuS沉淀;(2)温度较高时,H2O2分解,另外也可以加快反应速率;(3)ClO3-在酸性条件下具有强氧化性,与Fe2+发生氧化还原反应;(4)经过加入Na2S、H2O2、NaOH后可除去Cu、Zn、Fe、Cr等杂质,滤液中含有可溶性硫酸盐;(5)为防止Ni2+水解,可加硫酸溶解.
