问题
实验题
(13分) 用如右图装置进行铜与一定体积已知浓度的浓硫酸反应的实验研究。
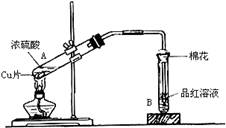
(1)写出试管B中的实验现象 。
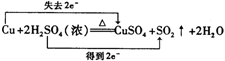
(2)写出A处反应的化学方程式,并用双线桥标明电子转移的方向和数目: 。
(3)充分反应后,该学生发现铜和硫酸都有剩余。在不补充浓硫酸的前提下,若要使剩余的铜片溶解,可再加入(要求填写一种不是酸类的物质) 。
(4)B试管口的棉花应沾有的试剂是 ,其作用是 ,离子方程式为 。
答案
(1)品红溶液褪色
(2)
(3)NaNO3、Fe2O3、FeCl3(其它合理答案均可)
(4)NaOH溶液 吸收尾气,防止污染 2OH-+SO2=SO32-+H2O
题目分析:(1)试管B中的现象是品红溶液褪色。(2)A处反应的化学方程式及双线桥为: 。(3)铜和浓硫酸反应时,当硫酸稀到一定程度时,该反应停止,如果想让铜继续溶解可以加入氧化剂,如NaNO3、Fe2O3、FeCl3等。(4)SO2是大气污染物,所以应该用NaOH溶液吸收,反应的离子方程式为:2OH-+SO2=SO32-+H2O。
。(3)铜和浓硫酸反应时,当硫酸稀到一定程度时,该反应停止,如果想让铜继续溶解可以加入氧化剂,如NaNO3、Fe2O3、FeCl3等。(4)SO2是大气污染物,所以应该用NaOH溶液吸收,反应的离子方程式为:2OH-+SO2=SO32-+H2O。
点评:本实验比较基础,难度小,可作为对学生进行基础训练的习题。
