用下图所示装实验置进行铜与浓硫酸反应的实验探究,请回答下列问题:
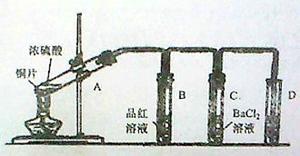
(1)试管A中发生反应的化学方程式为 。
(2)试管B中的实验现象是 ,将试管B中反应后的溶液进行加热,观察到试管B中的实验现象是 。
(3)反应一段时间后,试管C中没有观察到沉淀生成,若往试管C中通入或加入一种物质X,即生成白色沉淀,该物质X不可能是下列的 。(填序号)
a、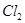 b、
b、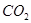 c、
c、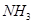 d、
d、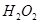
(4)试管A中的铜和硫酸充分反应后,铜和硫酸都有剩余,下列物质中能使试管A中的铜片继续溶解的是 。(填序号)
a、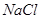 b、
b、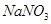 c、
c、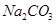 d、
d、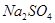
(5)试管D中的试剂是 溶液,其作用是 。
(13分)(1)Cu+2H2SO4(浓)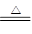 CuSO4+2H2O+SO2↑(3分)
CuSO4+2H2O+SO2↑(3分)
(2)品红溶液褪色;品红溶液又恢复为原来的颜色
(3) c ;(4) b ;(5) NaOH溶液;吸收二氧化硫气体
题目分析:(1)浓硫酸具有强氧化性,能氧化金属铜,则试管A中发生反应的化学方程式为Cu+2H2SO4(浓)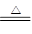 CuSO4+2H2O+SO2↑。
CuSO4+2H2O+SO2↑。
(2)SO2具有漂白性,则试管B中的实验现象是品红溶液褪色;由于SO2的漂白性是不稳定的,则在加热的条件下又恢复到原来的颜色,则将试管B中反应后的溶液进行加热,观察到试管B中的实验现象是品红溶液又恢复为原来的颜色。
(3)SO2溶于水生成亚硫酸,溶液显酸性,得不到亚硫酸钡白色沉淀。因此要生成白色沉淀则可以加入氧化剂或碱性气体,即选项abd都可以,其中ad生成的是硫酸钡白色沉淀,c是的亚硫酸钡白色沉淀,答案选b。
(4)在酸性条件下,硝酸盐具有强氧化性,能氧化单质铜,因此加入的物质是硝酸钠,答案选b。
(5)SO2是大气污染物,应该用氢氧化钠溶液吸收,防止污染空气。
点评:该题是高考中的常见题型,属于中等难度的试题。试题贴近高考,基础性强,在注重对学生基础知识巩固和训练的同时,侧重对学生能力的培养。有利于培养学生的逻辑推理能力和规范严谨的实验设计能力,也有助于调动学生的学习兴趣和学习积极性。
