某课外活动小组根据Mg与CO2的反应原理,探究Mg与NO2的反应及固体产物。该小组通过实验确认Mg能在NO2中燃烧,并对固体产物提出三种假设:
I.假设为:固体产物为MgO II.假设为:______________III.假设为:______________
请回答下列问题:资料信息:2NO2+2NaOH=NaNO3+NaNO2+H2O
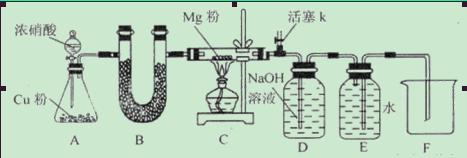
(1)如图连接好仪器,装药品前如何检验装置的气密性_____________________________
(2)装置B中盛装的干燥剂可以是(填序号)___________________
①浓硫酸 ②无水CaCl2 ③碱石灰 ④五氧化二磷
(3)开始打开活塞k,让A中反应进行一段时间,待C中充满红综色气体后,关闭活塞k,再点燃C处酒精灯,同时D中碱液盛的很满,这样做的目的是_________________________
(4)E中收集到的气体对氢气的相对密度是14,该气体是__________________
(5)实验得到固体残留物的质量是实验前Mg粉质量的1.5倍,则假设__________________成立。C中发生的化学反应方程式有_______________________________________________
(6)本实验中存在明显缺陷,改进措施是_______________________________________。
Ⅱ.固体产物为Mg3N2 Ⅲ.固体产物为MgO和Mg3N2 (1)关闭分液漏斗活塞和活塞K,将导气管末端插入水中,对锥形瓶(或C处反应管)微热,若导气管口有气泡,停止加热,导气管中进入一段水柱,表示气密性良好。 (2)②④ (3)排净装置中空气,防止空气干扰实验。
(4)N2 (5)假设Ⅲ 4Mg+2NO2 4MgO+N2 3Mg+N2
4MgO+N2 3Mg+N2 Mg3N2
Mg3N2
(6)活塞K处的导气管插入NaOH溶液中,进行尾气吸收。
题目分析:在NO2中含有N、O元素,所以Mg在其中燃烧产物可能是MgO、Mg3N2或它们的混合物。假设Ⅱ.固体产物为Mg3N2 。Ⅲ.固体产物为MgO和Mg3N2(1)如图连接好仪器,装药品前装置的气密性检验方法是:关闭分液漏斗活塞和活塞K,将导气管末端插入水中,对锥形瓶(或C处反应管)微热,若导气管口有气泡,停止加热,导气管中进入一段水柱,表示气密性良好。(2)Cu与浓硝酸反应产生的气体NO2是酸性气体,不能使用碱性干燥剂来干燥。排除 ③碱石灰;U形管装的是固体干燥剂,而浓硫酸是液体,不能使用,排除①浓硫酸。故装置B中盛装的干燥剂可以是②无水CaCl2 ④五氧化二磷。(3)开始打开活塞k,让A中反应进行一段时间,待C中充满红综色气体后,关闭活塞k,再点燃C处酒精灯,同时D中碱液盛的很满,这样做的目的是排净装置中空气,防止空气干扰实验。(4)E中收集到的气体对氢气的相对密度是14,相对分子质量为14×2=28,该气体是N2.(5)若完全转化为MgO,则反应后的固体质量是反应前的(24+16):24=1.67倍.若完全转化为Mg3N2,则反应后的固体质量是反应前的(24×3+14×2):(24×3)=1.39倍。实验得到固体残留物的质量是实验前Mg粉质量的1.5倍,所以得到的是MgO和Mg3N2的混合物。故假设设Ⅲ成立。C中发生的化学反应方程式有4Mg+2NO2 4MgO+N2 3Mg+N2
4MgO+N2 3Mg+N2 Mg3N2。(6)本实验中存在明显缺陷,就是没有尾气处理装置。改进措施是活塞K处的导气管插入NaOH溶液中,进行尾气吸收。2的反应及固体产物的成分。
Mg3N2。(6)本实验中存在明显缺陷,就是没有尾气处理装置。改进措施是活塞K处的导气管插入NaOH溶液中,进行尾气吸收。2的反应及固体产物的成分。
