用如下图所示装置可以完成一系列实验(图中夹持装置已略去)
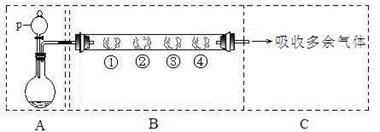
请回答下列问题:
I.(1)仪器p的名称是_________________,若用装置A由浓硫酸和亚硫酸钠固体制取SO2气体,并通过装置B完成表中设计实验,请填写表中空白:
| B中棉花的位置 | ① | ② | ③ |
| 所蘸试剂 | 石蕊试液 | 品红溶液 | 碘水(黄色) |
| 现象 | 褪色 | ||
| 体现SO2的性质 | 水溶液显酸性 |
(2)写出③中反应的离子方程式_________________________________________。
II.若用装置A由浓盐酸和高锰酸钾制取Cl2气体,装置B中的四处棉花依次做了如下处理:①蘸有FeCl2溶液 ②蘸有淀粉KI溶液 ③蘸有石蕊溶液 ④蘸有品红溶液
(1)写出①处发生反应的离子方程式_______________________________________。
(2)在实验过程中,③处能观察到的现象___________________________________。
(3)写出装置C中“吸收多余气体”所用的试剂_______________________________。
I.(1)分液漏斗(1分)
| 现象 | 变红(1分) | 褪色(1分) | |
| 体现SO2的性质 | 漂白性(1分) | 还原性(1分) |
(2)SO2+I2+2H2O=SO42-+4H++2I- (2分)
II.(1)2Fe 2++Cl2=2Fe3++2Cl- (2分)
(2)先变红后褪色(1分) (3)氢氧化钠(NaOH)溶液 (1分)
题目分析:I.(1)图中仪器p为分液漏斗;SO2溶于水生成H2SO3显酸性,所以石蕊变红;SO2使品红褪色,体现了SO2的漂白性;SO2通入碘水中,SO2被I2氧化,所以碘水褪色,体现了SO2的还原性。
(2)SO2、H2O与I2反应生成HI和H2SO4,HI和H2SO4为强电解质,拆成离子可得离子方程式。
II.(1)Cl2把FeCl2氧化为FeCl3,把FeCl2和FeCl3改写为离子可得离子方程式。
(2)Cl2与H2O反应生成HCl和HClO,显酸性使石蕊变红,HClO具有强氧化性,能漂泊石蕊,所以石蕊先变红后褪色。
(3)Cl2能与强碱溶液反应,所以用NaOH溶液吸收Cl2。
