有一种部分锈蚀的生铁样品,其成分是Fe、Fe2O3和C,课外小组的同学将100g稀盐酸分5次加到7.4g样品中(已知C不与稀盐酸反应,也不溶于水),充分反应后过滤、烘干得到滤渣0.2g,并将相关数据绘制如图.请计算:
(1)样品中铁的质量______g
(2)所用稀盐酸中溶质的质量分数.(计算结果保留到0.1%)
(3)反应后所得溶液中FeCl2的质量分数.(计算结果保留到0.1%)
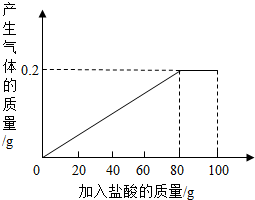
(1)设样品中铁的质量为X,生成的FeCl2 质量为Y,所消耗的盐酸的溶质的质量为Z;由图示可知铁与稀盐酸反应生成氢气0.2g,根据题意得:
Fe+2HCl═FeCl2+H2↑
56 73 127 2
X Z Y 0.2g
=56 x
=73 z
=127 y 2 0.2g
X=5.6g
Y=12.7g
Z=7.3g
(2)根据(1)所求铁与稀盐酸完全反应所用的盐酸溶液溶质的质量为7.3克,由据图示得铁与稀盐酸完全反应所用的盐酸溶液质量为80克,则:
所用稀盐酸中溶质的质量分数=
×100%=盐酸溶质的质量 盐酸溶液的质量
×100%≈9.1%7.3g 80g
(3)反应后溶液的总质量=100+7.4-0.2-0.2=107克;由(1)解得可知生成的FeCl2为12.7克,则反应后所得溶液中FeCl2的质量分数=
×100%=氯化亚铁的质量 反应后溶液的总质量
×100%≈11.9%12.7g 107g
答:(1)样品中铁的质量 5.6g;(2)所用稀盐酸中溶质的质量分数9.1%;(3)反应后所得溶液中FeCl2的质量分数11.9%.
