某研究性学习小组按下图所示装置进行探究实验。
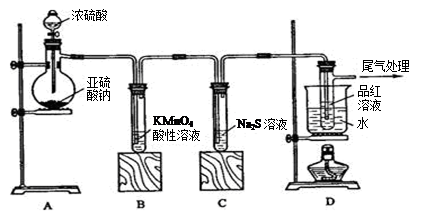
请回答下列问题:
(1)装置A中发生反应的化学方程式为 。
(2)实验过程中,装置B发生的现象是 ,发生反应的离子方程式为 。
(3)装置C中发生的现象是 ,这说明SO2具有的性质是 。
(4)装置D的目的是探究SO2与品红作用的稳定性,请写出实验操作及现象
。
(5)试设计实验验证装置B溶液是否含有SO42- 。
(6)试在框图内画出SO2尾气处理装置图。

(1) Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O (2分)
(2)溶液由紫红色(1分)变为无色(1分)或紫红色酸性高锰酸钾褪色
5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+(2分)
(3)无色溶液出现黄色(1分)浑浊或沉淀 (1分) 氧化性(1分)
(4)品红溶液褪色后,关闭分液漏斗活塞(1分);点燃酒精灯加热(1分),溶液恢复红色(1分)
或:取少量褪色后品红溶液于试管(1分),加热(1分),溶液恢复红色(1分)
(5)取少量待测液,滴加入适量氯化钡溶液,若有白色沉淀产生,说明含有SO42-(操作、现象、结论全对得1分);若无白色沉淀产生,说明没有SO42-(现象、结论全对得1分)。(“先加入足量稀盐酸酸化”,不扣分)
(6) (2分,其中装置1分,标注试剂1分,装置、试剂
(2分,其中装置1分,标注试剂1分,装置、试剂
题目分析:(1)浓硫酸是强酸,和亚硫酸钠反应生成硫酸钠、SO2和水,因此装置A是制备SO2的,所以装置A中发生反应的化学方程式为Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O。
(2)SO2具有还原性,酸性高锰酸钾溶液具有强氧化性,和SO2发生氧化还原反应,因此实验过程中,装置B发生的现象是溶液由紫红色变为无色或紫红色酸性高锰酸钾褪色,发生反应的离子方程式为5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+。
(3)SO2中S元素的化合价是+4价,具有氧化性。Na2S中S元素的化合价是-2价,具有还原性。因此SO2通入到Na2S溶液中发生氧化还原反应生成单质S沉淀,所以装置C中发生的现象是无色溶液出现黄色浑浊或沉淀,反应的离子方程式为SO2+2S2-+2H2O=3S↓+4OH-。
(4)由于SO2的漂白性不稳定,在加热的条件下又恢复到原来的颜色,因此探究SO2与品红作用的稳定性的实验操作及现象是品红溶液褪色后,关闭分液漏斗活塞,点燃酒精灯加热,溶液恢复红色或取少量褪色后品红溶液于试管,加热,溶液恢复红色。
(5)硫酸钡是不溶于水也不溶于酸的白色沉淀,据此可以检验SO42-。因此验证装置B溶液是否含有SO42-的方法是取少量待测液,滴加入适量氯化钡溶液,若有白色沉淀产生,说明含有SO42-,若无白色沉淀产生,说明没有SO42-。
(6)SO2是大气污染物,需要尾气处理。由于SO2是酸性氧化物,可以用氢氧化钠溶液吸收,因此正确的装置图为 。2制备、性质验证、尾气处理以及离子检验
。2制备、性质验证、尾气处理以及离子检验
