黄铁矿是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对某黄铁矿石(主要 成分为FeS2)进行硫元素含量测定的实验探究及工业生产硫酸的探究。
I .将m1,g该黄铁矿样品(杂质中不含硫和铁)放入如下图所示装置(夹持和加热装置 省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:4FeS2 + 11O2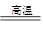 2Fe2O3 + 8SO2
2Fe2O3 + 8SO2
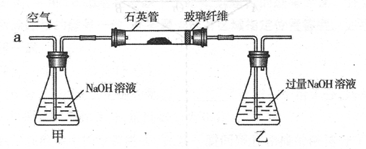
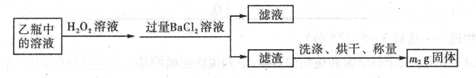
II反应结束后,将乙瓶中的溶液进行如下处理
(1)I中,乙瓶内发生反应的离子方程式有____________、__________。
(2)II中,所加H2O2溶液需足量的理由是____________________________
(3)该黄铁矿石中硫元素的质量分数为____________________________
(4)简述在催化反应室中设置热交换器的目的:______________。
(5)工业生产中常用氨——硫酸法进行尾气脱硫,以达到消除污染、废物利用的目的,用 两个化学方程式表示其反应原理_______________、______________
(15分)
(1)SO2 + 2OH-=SO32- + H2O (2分)2SO32-+ O2= 2SO42-(2分)
(2)使SO32-完全氧化为SO42- (2分)(3) ×100%
×100%
(4)利用SO2氧化为SO3时放出的热量来预热即将参加反应的SO2和O2等(2分)
SO2+2NH3•H2O═(NH4)2SO3,(NH4)2SO3+H2SO4═(NH4)2SO4+SO2↑+H2O.(2分)
题目分析:(1)乙中二氧化硫和氢氧化钠反应生成亚硫酸钠,离子方程式为 SO2+2OH-=SO32-+H2O,亚硫酸钠和氧气反应生成硫酸钠,离子方程式为2SO32-+O2=2SO42-,故答案为: SO2+2OH-=SO32-+H2O;2SO32-+O2=2SO42-;(2)为使亚硫酸根离子完全转化为硫酸根离子,加入的双氧水要足量,故答案为:使SO32-完全氧化为SO42-;(3)最终所得沉淀是硫酸钡,根据硫原子守恒得硫的质量,设硫的质量为x,
S-----BaSO4
32g 233g
x m2g
x= g 质量分数=
g 质量分数=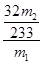 ×100%=
×100%= ×100%
×100%
(4)在S02催化氧化设备中设置热交换器,把不同温度之间的气体进行热交换,可预热反应气体,冷却生成气体,可起到充分利用能源的目的,(5)工业生产中常用氨-酸法进行尾气脱硫,即先用氨水吸收,再用浓硫酸处理.先用氨水吸收时,发生反应:SO2+2NH3•H2O═(NH4)2SO3,再用浓硫酸处理时,发生反应:(NH4)2SO3+H2SO4═(NH4)2SO4+SO2↑+H2O,以达到消除污染、废物利用的目的.
故答案为:SO2+2NH3•H2O═(NH4)2SO3,(NH4)2SO3+H2SO4═(NH4)2SO4+SO2↑+H2O.
