某化学小组进行Na2SO3的性质实验探究。
(1)在白色点滴板的a、b、c三个凹槽中滴有Na2SO3溶液,再分别滴加下图所示的试剂:
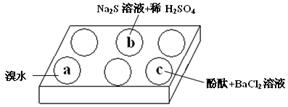
实验现象如下表:
| 编号 | 实验现象 |
| a | 溴水褪色 |
| b | 产生淡黄色沉淀 |
| c | 滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去 |
根据实验现象进行分析:
① a中实验现象证明Na2SO3具有 性。
② b中发生反应的离子方程式是 。
③ 应用化学平衡原理解释c中现象(用化学用语及简单文字表述) 。
(2)在用NaOH 溶液吸收SO2的过程中,往往得到Na2SO3和NaHSO3的混合溶液,溶液pH 随n(SO32-):n(HSO3-) 变化关系如下表:
| n(SO32—): n(HSO3—) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
① 当吸收液中n(SO32-):n(HSO3-) ="10:1" 时,溶液中离子浓度关系正确的是 (填字母)。
A.c(Na+) +c(H+) = 2c(SO32-) +c(HSO3-) + c(OH-)
B.c(Na+) > c(HSO3-) > c(SO32-) > c(OH-)>c(H+)
C.c(Na+) > c(SO32-) > c(HSO3-) > c(OH-)>c(H+)
②若n(SO32-):n(HSO3-) = 3:2,则0.8 mol NaOH溶液吸收了标准状况下的SO2 L。
(10分)
(1)①还原性 (2分)
②SO32-+2S2-+6H+=" 3S↓+3" H2O (2分)
③在Na2SO3溶液中,SO32-水解显碱性:SO32-+H2O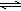 HSO3-+OH-,所以滴入酚酞后溶液变红;在该溶液中加入BaCl2后,Ba2++SO32-=BaSO3↓(白色),由于c(SO32-)减小,SO32-水解平衡左移,c(OH-)减小,红色褪去。(2分)
HSO3-+OH-,所以滴入酚酞后溶液变红;在该溶液中加入BaCl2后,Ba2++SO32-=BaSO3↓(白色),由于c(SO32-)减小,SO32-水解平衡左移,c(OH-)减小,红色褪去。(2分)
(2)①AC (2分)
②11.2 (2分)
题目分析:(1)①SO2+Br2+2H2O=H2SO4+2HBr,SO2中S化合价升高,被氧化,显还原性,答案:还原性 (2分)
②酸性条件下,+4价的S和-2价的S反应,生成0价的S,故有淡黄色沉淀,答案:SO32-+2S2-+6H+=" 3S↓+3" H2O (2分)
③SO32―是弱酸根离子,水解后呈碱性,加Ba2+水解平衡被破坏;答案:在Na2SO3溶液中,SO32-水解显碱性:SO32-+H2O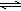 HSO3-+OH-,所以滴入酚酞后溶液变红;在该溶液中加入BaCl2后,Ba2++SO32-=BaSO3↓(白色),由于c(SO32-)减小,SO32-水解平衡左移,c(OH-)减小,红色褪去。(2分)
HSO3-+OH-,所以滴入酚酞后溶液变红;在该溶液中加入BaCl2后,Ba2++SO32-=BaSO3↓(白色),由于c(SO32-)减小,SO32-水解平衡左移,c(OH-)减小,红色褪去。(2分)
(2)①A正确,溶液中存在电荷守恒,B不正确,c(SO32-) > c(HSO3-),C、正确,n(SO32—): n(HSO3—)= 91:9时,pH=8.2,溶液呈碱性,c(Na+) > c(SO32-) > c(HSO3-) > c(OH-)>c(H+),正确。故答案:AC (2分)
②若n(SO32-):n(HSO3-) = 3:2,则0.8 mol NaOH溶液吸收了标准状况下的SO2的体积,令n(SO32-)=3x,则由Na+ 守恒得:3x×2+2x=0.8mol,x=0.1mol,n(SO2)=0.5mol,v(SO2 )=0.5mol×22.4l·mol-1=11.2L,答案:11.2 (2分)
