某研究性学习小组将一定浓度Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀。
甲同学认为两者反应只生成CuCO3一种沉淀;
乙同学认为这两者相互促进水解反应,生成一种Cu(OH)2沉淀;
丙同学认为生成CuCO3和Cu(OH)2两种沉淀。
(查阅资料知:CuCO3和Cu(OH)2均不带结晶水)
Ⅰ.按照乙同学的理解Na2CO3溶液和CuSO4溶液反应的离子反应方程式为: _ ;
在探究沉淀物成分前,须将沉淀从溶液中分离并净化。具体操作为 ①过滤②洗涤③干燥。
Ⅱ.请用下图所示装置,选择必要的试剂,定性探究生成物的成分。
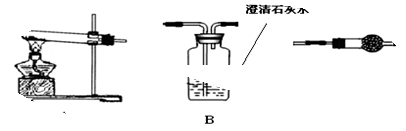
(1)各装置连接顺序为 
 。
。
(2)装置C中装有的试剂名称是 。
(3)按你的装置连接顺序,甲的猜想是正确的,则可通过________________________现象来说明甲的猜想是正确的。
Ⅲ.若CuCO3和Cu(OH)2两者都有,丙同学通过装置Ⅰ进行定量分析来测定其组成。
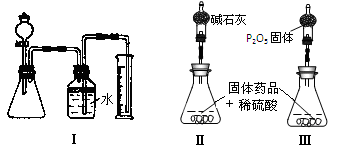
(1)实验有关操作为:①往锥形瓶中放入适量的样品:②从分液漏斗往锥形瓶中加入过量的稀硫酸;③检验装置的气密性;④测定收集到水的体积。
正确的操作顺序为____________________。
(2)广口瓶中水的上面覆盖了一层植物油,若瓶中的液体没有装满(上方留有少量空间),实验测得CO2的体积将___________(填偏大、偏小或不变)。
(3)若实验中测得样品的质量为wg,气体的体积为aL(标况下),则样品中CuCO3的质量分数为___________(CuCO3的式量为124)。
(4)丁同学认为,丙同学的实验方法,可能因气体体积测量不准,导致误差较大。建议改用图中的Ⅱ、III装置进行实验。只需进行简单而又必要的数据测定,可比较准确地确定样品中CuCO3的质量分数,较合理的装置_______(填代号)。但是丁同学的装置仍然有缺陷,所测结果将偏高或偏低__________。理由是___________________________
Ⅰ.Cu2++CO32-+H2O=Cu(OH)2+CO2
Ⅱ.ACB 无水硫酸铜 C中固体不变蓝,B中出现浑浊
Ⅲ. 3124 不变 a/22.4×124/W Ⅲ
偏高 锥形瓶中水蒸气残留 或者偏低 吸收空气中的水蒸气
题目分析:
Ⅰ乙同学的认为:这两者相互促进水解反应,生成Cu(OH)2一种沉淀,即是碳酸钠和硫酸铜之间发生双水解反应,原理为:Na2CO3+CuSO4+H2O═Cu(OH)2↓+Na2SO4+CO2↑
Ⅱ.(1)利用加热装置验证生成的产物,利用A加热分解碳酸铜或氢氧化铜,利用C检验是否有水生成验证是否含有氢氧化铜;利用装置B中 石灰水变浑浊证明生成二氧化碳验证碳酸铜的存在,所以装置连接为A、C、B;
(2)无水硫酸铜可以检验水的产生和存在,放在干燥管中来检验,故答案为:无水硫酸铜;
(3)碳酸铜受热分解会产生氧化铜和二氧化碳,二氧化碳可以使澄清的石灰水变浑浊,
Ⅲ(1)应先进行装置气密性检验,然后依次加入固体药品、液体药品,最后进行气体排出水的测量,确定产生气体体积;
(2)广口瓶的液体没有装满,不会影响测定的结果
(3)产生的气体二氧化碳气体的体积为aL,n CO2="n" CuCO3=" a/22.4,m" CuCO3= a/22.4×124
则样品中CuCO3的质量分数为a/22.4×124/W
(4)较合理的装置是Ⅲ,因为用碱石灰吸收二氧化碳和水,无法求出CuCO3的质量。P2O5只吸收水蒸气。先求Cu(OH)2,再求得CuCO3的质量。
此题的答案是开放性的,只要合理就行;偏高 锥形瓶中水蒸气残留 或者偏低 盛有P2O5的干燥管吸收空气中的水蒸气,质量偏大,导致Cu(OH)2质量偏大,测得的CuCO3的质量分数偏低。
