无水硫酸铜受热分解生成氧化铜和气体,受热温度不同生成的气体成分也不同。气体成分可能含SO3、SO2和O2中的一种、两种或三种。某化学课外活动小组设计探究性实验,测定反应产生的SO3、SO2和O2的物质的量,并计算确定各物质的化学计量数,从而确定CuSO4分解的化学方程式。实验用到的仪器如下图所示:
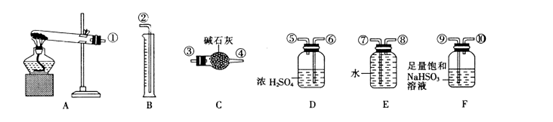
【提出猜想】
猜想I.硫酸铜受热分解所得气体的成分可能只含SO3一种;
猜想Ⅱ.硫酸铜受热分解所得气体的成分可能只含_______两种。
猜想Ⅲ.硫酸铜受热分解所得气体的成分可能含有_______三种。
【实验探究】
已知实验结束时,硫酸铜完全分解。
(1)组装探究实验的装置,按从左至右的方向,各仪器接口连接顺序为①→⑨→⑩→⑥→⑤→____→_____→_____→______→②。(填接口序号)
(2)若实验结束时装置B中量筒没有收集到水,则证明猜想_______(填“I”“Ⅱ”或“Ⅲ’’)正确。
(3)有两个实验小组进行该实验,由于加热时的温度不同,实验结束后,测得相关数据也不
同,数据如下:
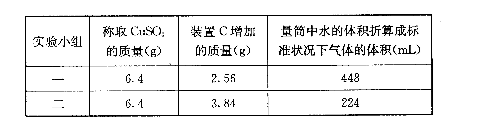
请通过计算,推断出在第一小组和第二小组的实验条件下CuSO4分解的化学方程式:
第一小组:_____________________________________________________________;
第二小组:_____________________________________________________________。
SO2、O2;SO3、SO2、O2(1)③,④,⑧,⑦(2)Ⅰ(3)2CuSO4 2CuO+2SO2↑+O2↑;4CuSO4
2CuO+2SO2↑+O2↑;4CuSO4 4CuO+2SO2↑+2SO3↑+O2↑
4CuO+2SO2↑+2SO3↑+O2↑
题目分析:【提出假设】根据硫酸铜分解可能发生两种情况2CuSO4 2CuO+2SO2↑+O2↑或CuSO4
2CuO+2SO2↑+O2↑或CuSO4 CuO+SO3↑或者两个反应同时发生来判断,故Ⅱ. SO2、O2;Ⅲ. SO3、SO2、O2(1)体的制备和收集按照发生装置→气体吸收装置→排水→测量装置来安装实验仪器,故答案为:③④⑧⑦;(2)SO3与SO2均易溶于水、O2不溶于水,实验结束时装置B中量筒没有收集到水,说明产生易溶于水的气体SO3或SO2,没有产生O2,故证明猜想I(3)SO2、SO3气体能与碱性物质反应,用碱石灰可吸收SO2、SO3气体,则装置C增加的质量即为产生SO3与SO2质量和,O2不溶于水,实验结束时装置B中量筒收集到水的体积即为产生的O2体积,第一小组:设6.4g硫酸铜分解生成xmolSO3,ymolSO2,则80x+64y=2.56g,x+y=
CuO+SO3↑或者两个反应同时发生来判断,故Ⅱ. SO2、O2;Ⅲ. SO3、SO2、O2(1)体的制备和收集按照发生装置→气体吸收装置→排水→测量装置来安装实验仪器,故答案为:③④⑧⑦;(2)SO3与SO2均易溶于水、O2不溶于水,实验结束时装置B中量筒没有收集到水,说明产生易溶于水的气体SO3或SO2,没有产生O2,故证明猜想I(3)SO2、SO3气体能与碱性物质反应,用碱石灰可吸收SO2、SO3气体,则装置C增加的质量即为产生SO3与SO2质量和,O2不溶于水,实验结束时装置B中量筒收集到水的体积即为产生的O2体积,第一小组:设6.4g硫酸铜分解生成xmolSO3,ymolSO2,则80x+64y=2.56g,x+y=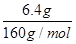 =0.04mol,解得x=0mol,y=0.04mol,又n(O2)=
=0.04mol,解得x=0mol,y=0.04mol,又n(O2)=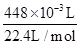 =0.02mol,即SO2与O2的物质的量之比为2:1,故答案为:2CuSO4
=0.02mol,即SO2与O2的物质的量之比为2:1,故答案为:2CuSO4 2CuO+2SO2↑+O2↑;第二小组设6.4g硫酸铜分解生成xmolSO3,ymolSO2,则80x+64y=3.84g,x+y=
2CuO+2SO2↑+O2↑;第二小组设6.4g硫酸铜分解生成xmolSO3,ymolSO2,则80x+64y=3.84g,x+y=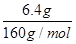 =0.04mol,解得x=0.02mol,y=0.02mol,又n(O2)=
=0.04mol,解得x=0.02mol,y=0.02mol,又n(O2)=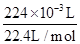 =0.01mol,即物质的量SO3:SO2:O2=2:2:1,故答案为:4CuSO4
=0.01mol,即物质的量SO3:SO2:O2=2:2:1,故答案为:4CuSO4 4CuO+2SO2↑+2SO3↑+O2↑。
4CuO+2SO2↑+2SO3↑+O2↑。
