工业上常用含少量SiO2、Al2O3的铬铁矿(FeO Cr2O3)冶炼铬,简要流程如下:
Cr2O3)冶炼铬,简要流程如下:
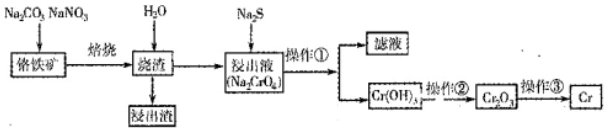
(1)完成下列化学方程式(在横线填写物质的化学式及系数):
2FeO·Cr2O3+4Na2CO3+7NaNO3 4Na2CrO4+Fe2O3+4CO2+______________。
4Na2CrO4+Fe2O3+4CO2+______________。
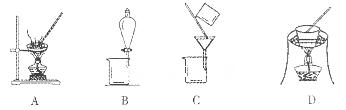
(2)操作①包括过滤与洗涤,在实验室中进行洗涤沉淀的操作__________________________________。操作②可选用的装置(部分夹持装置略去)是________(填序号)
(3)写出能够完成操作③的相关反应的化学方程式:_____________________。
(4)化学需氧量(COD)可度量水遭受有机物污染的程度。在强酸并加热的条件下,用K2Cr2O7做强氧化剂处理水样,并测定消耗的K2Cr2O7的量,然后换算成相当于O2的含量称为化学需氧量(以mg/L计)。化学兴趣小组测定某水样的化学需氧量(COD)过程如下:
I.取amL水样置于锥形瓶,加入10.00mL 0.2500 mol/L的K2Cr2O7溶液;
II.……。
III.加指示剂,用c mol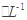 的硫酸亚铁铵[ (NH4)2Fe(SO4)
的硫酸亚铁铵[ (NH4)2Fe(SO4)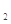 ]滴定,终点时消耗b mL(此步骤的目的是用Fe2+把多余的Cr2O72-转化为)Cr3+。
]滴定,终点时消耗b mL(此步骤的目的是用Fe2+把多余的Cr2O72-转化为)Cr3+。
①I中量取K2Cr2O7溶液的仪器是_____________;
②计算该水样的化学需氧量时需用到下列关系:要除去1molCr2O72- 需消耗___molFe2+,1molCr2O72-相当于_______ molO2。
(1)7NaNO2(2分)
(2)向漏斗中加蒸馏水至浸没沉淀,待液体流下,重复操作2~3次(2分) D(2分)
(3)2C2O3 4Cr+3O2↑或2Al+C2O3
4Cr+3O2↑或2Al+C2O3 2Cr+Al2O3(2分,其它答案合理也给分)
2Cr+Al2O3(2分,其它答案合理也给分)
(4)①酸式滴定管或移液管(1分) ②6 1.5(每空1分,共2分)
题目分析: (1)根据反应前后元素的化合价变化可知,反应前铁元素的化合价从+2价升高到+3价,失去1个电子。Cr元素的化合价从+3价升高到+6价,失去3个电子。而O、Na、C的化合价均没有变化,所以根据电子的得失守恒可知,氮元素的化合价一定降低。由于铁元素共失去2个电子,Cr元素共失去12个电子。因此7个氮原子得到14个电子,则氮元素的化合价从+5价降低到+3价,所以还原产物是NaNO2。
(2)过滤后的沉淀洗涤是在过滤器中完成的,所以在实验室中进行洗涤沉淀的操作是向漏斗中加蒸馏水至浸没沉淀,待液体流下,重复操作2~3次;操作②是Cr(OH)3分解生成Cr2O3,固体加热分解在坩埚中进行。A是蒸发,B是分液,C是过滤,因此答案选D。
(3)Cr元素是高熔点金属,可以通过铝热反应或电解法冶炼,反应的方程式分别为2C2O3 4Cr+3O2↑或2Al+C2O3
4Cr+3O2↑或2Al+C2O3 2Cr+Al2O3。
2Cr+Al2O3。
(4)①K2Cr2O7溶液显酸性且具有强氧化性,因此需要用酸式滴定管或移液管量取。
②K2Cr2O7在氧化还原反应中Cr元素的化合价从+6价降低到+3价,得到3个电子。而亚铁离子中铁元素的化合价从+2价升高到+3价,失去3个电子。因此根据电子得失守恒可知,去1molCr2O72- 需消耗6molFe2+。由于1mol氧气做氧化剂得到4mol电子,所以molCr2O72-相当于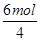 =1.5molO2。
=1.5molO2。
