接触法制硫酸是先把SO2催化氧化成SO3,然后用浓硫酸吸收得到的SO3制取产品。某工厂生产硫酸时,进入接触室的原料气成分为SO27%、O2 11%、N2 82%(体积分数)。
(1)计算标准状况下10 m3原料气中的SO2物质的量______________mol。
(2)计算标准状况下1 0m3原料气的质量 千克。
(3)若SO2的转化率为99.2%,计算接触室导出的气体中SO3的体积分数 。
(4)若接触室导出的气体中含6.72%(体积分数)的SO3。把出口气体送进吸收塔,用
98.3%的硫酸吸收,可得到“发烟H2SO4”(H2SO4和SO3的混合物,其中含质量分数为20%的SO3)。计算吸收1000 m3出口气体(已折算为标准状况)所需要的98.3%的硫酸的质量 千克。
(1)31.25(2分)
(2)13.82Kg(4分)
(3)7.19%(4分)
(4)665Kg(6分)
题目分析:(1)原料气中SO2的体积分数为7%,故10m3原料气中的SO2的体积为10m3×7%=0.7m3=700L,故标准状况下二氧化硫的物质的量为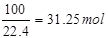 故答案为:31.25;
故答案为:31.25;
(2)原料气中O2的体积分数为11%,故10m3原料气中的O2的体积为10m3×11%=1.1m3=1100L,故标准状况下氧气的物质的量为 原料气中N2的体积分数为82%,故10m3原料气中的N2的体积为10m3×82%=8.2m3=8200L,故标准状况下氮气的物质的量为
原料气中N2的体积分数为82%,故10m3原料气中的N2的体积为10m3×82%=8.2m3=8200L,故标准状况下氮气的物质的量为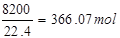 故标准状况下10m3原料气的质量为:31.25mol×64g/mol+49.11mol×32g/mol+366.07mol×28g/mol=13821.48≈13.82kg,答:标准状况下10m3原料气的质量为13.82kg;
故标准状况下10m3原料气的质量为:31.25mol×64g/mol+49.11mol×32g/mol+366.07mol×28g/mol=13821.48≈13.82kg,答:标准状况下10m3原料气的质量为13.82kg;
(3)SO2的转化率为99.2%,则参加反应的二氧化硫的体积为10m3×7%×99.2%=0.6944m3,则:
2SO2+O2=2SO3 体积减少△V
2 2 1
0.6944m3 0.6944m3 0.3472m3
故反应后气体的体积为10m3-0.3472m3=9.6528m3,
故接触室导出的气体中SO3的体积为0.6944m3,体积分数为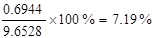
答:接触室导出的气体中SO3的体积分数为7.19%;
(4)假设需要浓硫酸的质量为mg,则浓硫酸中硫酸的质量为mg×98g%=0.98mg,物质的量为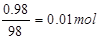 浓硫酸中水的质量为mg-0.98mg=0.02mg,物质的量为
浓硫酸中水的质量为mg-0.98mg=0.02mg,物质的量为 故吸收三氧化硫后生成的硫酸的物质的量为
故吸收三氧化硫后生成的硫酸的物质的量为 发烟硫酸中硫酸的物质的量为0.01m mol+
发烟硫酸中硫酸的物质的量为0.01m mol+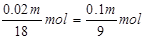 1000m3出口气体中三氧化硫的体积为1000m3×6.72%=67.2m3=67200L,SO3的物质的量为
1000m3出口气体中三氧化硫的体积为1000m3×6.72%=67.2m3=67200L,SO3的物质的量为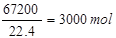 被水吸收后剩余的三氧化硫的物质的量为3000mol-
被水吸收后剩余的三氧化硫的物质的量为3000mol-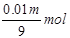
故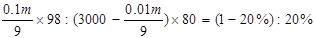 ,解得m=664615g=664.6kg,
,解得m=664615g=664.6kg,
答:吸收1000m3出口气体所需要的98%的硫酸的质量为664.6kg.
