半导体生产中常需要控制掺杂,以保证控制电阻率,三氯化磷(PCl3)是一种重要的掺杂剂。实验室要用黄磷(白磷)与干燥的Cl2模拟工业生产制取PCl3,装置如下图所示:(部分夹持装置略去)
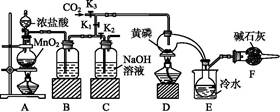
已知黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5。PCl3遇水会强烈水解生成H3PO3和HCl,遇O2会生成POCl3,POCl3溶于PCl3。PCl3、POCl3的熔沸点见下表:
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
请回答下列问题:
(1)A装置中制氯气的离子方程式为 。
(2)B中所装试剂是 ,E中冷水的作用是 ,F中碱石灰的作用是 。
(3)实验时,检查装置气密性后,先打开K3通入干燥的CO2,再迅速加入黄磷。通入干燥CO2的作用是 。通过控制K1、K2能除去A、B装置中的空气,具体的方法是 。
(4)粗产品中常含有POCl3、PCl5等。加入黄磷加热除去PCl5后,通过 (填实验操作名称),即可得到较纯净的PCl3。
(1)MnO2+4H++2Cl- Mn2++2H2O+Cl2↑
Mn2++2H2O+Cl2↑
(2)浓硫酸 冷却PCl3,防止挥发 吸收多余的Cl2,防止空气中的水蒸气进入烧瓶与PCl3反应
(3)排尽装置中的空气,防止白磷自燃 先关闭K1,打开K2,等B中溶液上方充满黄绿色气体后,打开K1,关闭K2
(4)蒸馏
(2)评价成套装置最后的仪器作用一般从两个方面考虑:①尾气处理;②防止空气干扰;(3)注意除去A、B装置中的空气,无法用CO2除,只能用生成的Cl2来排除;(4)依据信息“POCl3溶于PCl3,PCl3、POCl3的熔沸点”可知分离混合物的方法
