硝基苯是重要的精细化工原料,是医药和染料的中间体,还可做有机溶剂。制备硝基苯的过程如下:①配制混酸:组装如下图反应装置。
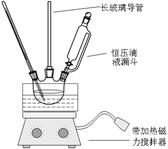
取100 mL烧杯,用20 mL浓硫酸与浓硝酸18 mL配制混和酸,加入漏斗中。把18 mL苯加入三颈烧瓶中。
②向室温下的苯中逐滴加入混酸,边滴边搅拌,混和均匀。
③在50-60℃下发生反应,直至反应结束。
④除去混和酸后,粗产品依次用蒸馏水和10%Na2CO3溶液洗涤,最后再用蒸馏水洗涤得到粗产品。
已知(1)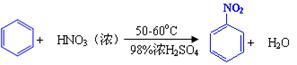
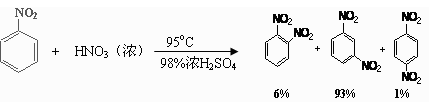
(2)可能用到的有关数据列表如下
| 物质 | 熔点/℃ | 沸点/℃ | 密度(20 ℃) / g·cm-3 | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
| 1,3-二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
| 浓硝酸 |  | 83 | 1.4 | 易溶于水 |
| 浓硫酸 |  | 338 | 1.84 | 易溶于水 |
请回答下列问题:
(1)配置混酸应先在烧杯中先加入 。
(2)恒压滴液漏斗的优点是 。
(3)实验装置中长玻璃管可用 代替(填仪器名称)。
(4)反应结束后产品在液体的 层(填“上”或者“下”),分离混酸和产品的操作方法为 。
(5)用10%Na2CO3溶液洗涤之后再用蒸馏水洗涤时,怎样验证液体已洗净? 。
(6)为了得到更纯净的硝基苯,还须先向液体中加入 除去水,然后蒸馏,
(1)浓硝酸
(2)可以保持漏斗内压强与发生器内压强相等,使漏斗内液体能顺利流下
(3)冷凝管(球形冷凝管或直行冷凝管均可)
(4)上 分液
(5)取最后一次洗涤液,向溶液中加入氯化钙,无沉淀生成,说明已洗净。
(6) 氯化钙
题目分析:(1)由于浓硫酸的密度比浓硝酸的大,当浓硫酸遇水时放出大量的热,所以配置混酸应将浓硫酸加入到浓硝酸中,也就是先在烧杯中先加入浓硝酸。(2)由于在反应的过程中不断加热,会产生大量的气体,这对于液体的加入很不利。若采用恒压滴液漏斗滴加,可以保持漏斗内压强与发生器内压强相等,使漏斗内液体能顺利流下。(3)在实验的过程中苯、硝酸会因为加热而气化,导致物质的浪费与环境污染,所以在装置中长玻璃管可以起到冷凝、降温使物质回流的作用。因此可用冷凝管等冷凝装置代替。(4)反应结束后产生的硝基苯、1,3-二硝基苯都不溶解于水的液体,密度比酸的混合溶液小。所以反应结束后产品在液体的上层,分离互不相溶的两层液体的方法是分液。(5)对于得到的粗产品依次用蒸馏水和10%Na2CO3溶液洗涤,最后再用蒸馏水洗涤。如果洗涤干净,则洗涤液中不含有CO32-。所以检验液体已洗净的方法是取最后一次洗涤液,向溶液中加入氯化钙,若无沉淀生成,说明已洗净。(6)为了得到更纯净的硝基苯,使之不含有水,可以先向液体中加入有吸水干燥作用的无水CaCl2,除去水,然后蒸馏。就得到了产品。