某合金可能由铜与镁、锌中的一种组成,现欲测定其组成,进行如下实验:取该合金样品30g放入烧杯中,然后将200g溶质质量分数为19.6%的稀硫酸平均分四次依次加入该烧杯中,每次均充分反应.实验数据如下:
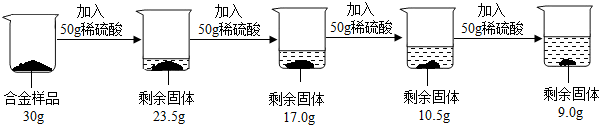
请计算:
(1)该合金中铜的质量分数为______.
(2)该合金除铜外,另一种金属是______.(写出过程)
(3)第三次加入稀硫酸充分反应后,所得溶液中溶质的质量分数.
(1)由图中信息可以知道,在前三次加入稀硫酸时,固体质量均减少6.5g,但是第四次加入稀硫酸固体质量只减少了1.5g,说明第四次中稀硫酸有剩余,所以固体中铜的质量为9.0g,所以铜的质量分数为:
×100%=30%;9.0g 30g
(2)6.5g金属和50g稀硫酸恰好完全反应,其中硫酸的质量为:50g×19.6%=镁和锌在发生置换反应时都生成+2价的硫酸盐,故设金属的相对原子质量为X,则:
M+H2SO4═MSO4 +H2↑
X 98
6.5g 9.8g
=X 98 6.5g 9.8g
解得:X=65,
所以该金属为锌;
(3)第三次加入稀硫酸充分反应后,生成硫酸锌的质量为y,氢气的质量为z,则:
Zn+H2SO4═ZnSO4+H2↑
98 161 2
9.8g×3 y z
=29.4g
=98 29.4g
=161 y 2 z
解得:y=48.3g,z=0.6g;
所得溶液中溶质的质量分数为:
×100%=28.6%.48.3g 19.5g+150g-0.6g
答:第三次加入稀硫酸充分反应后,所得溶液中溶质的质量分数为28.6%.
故答案为:(1)30%;(2)锌;(3)28.6%.
