海洋是巨大的化学资源宝库。下面是海水化学资源综合利用的部分流程图:
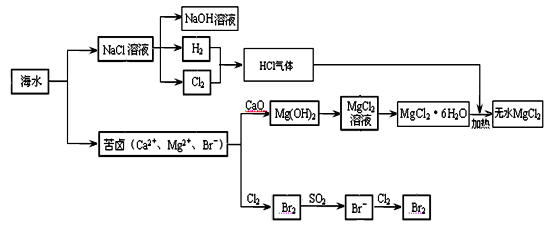
回答:
(1)由海水晒制的粗盐中含有Ca2+、Mg2+、SO42-等离子,为了除去这些离子,需要依次加入稍过量的NaOH、BaCl2、__ ___(填试剂化学式),然后__ ___(填操作名称)。在溶液中再加适量 (填试剂),加热蒸干溶液即得到精盐。
(2)某同学在实验室模拟氯碱工业的生产原理电解饱和食盐水。用玻璃棒蘸浓氨水检验阳极产生的气体,发现产生大量白烟。阳极生成的气体是 ,白烟的主要成分是 。
(3)制取MgCl2的过程中涉及反应:MgCl2·6H2O MgCl2 + 6H2O,该反应要在HCl气流中进行,原因是 。
MgCl2 + 6H2O,该反应要在HCl气流中进行,原因是 。
(4)苦卤中通入Cl2置换出Br2,吹出后用SO2吸收转化为Br-,反复多次,以达到富集溴的目的。由海水提溴过程中的反应可得出Cl-、SO2、Br-还原性由强到弱的顺序是_________。
(1)Na2CO3、过滤、盐酸或HCl(各1分) (2)Cl2或氯气、NH4Cl(各1分)
(3)MgCl2容易水解,MgCl2 + 2H2O Mg(OH)2 + 2HCl ,在HCl 气流中,可以抑制MgCl2水解,同时带走水分。(2分,两个要点各1分) (4)SO2>Br->Cl-(2分)
Mg(OH)2 + 2HCl ,在HCl 气流中,可以抑制MgCl2水解,同时带走水分。(2分,两个要点各1分) (4)SO2>Br->Cl-(2分)
题目分析:(1)Ca2+用碳酸钠除去,Mg2+用氢氧化钠除去,SO42-用氯化钡除去,最后加入盐酸酸化。但由于过量的氯化钡要用碳酸钠来除,所以碳酸钠必需放在氯化钡的后面,而氢氧化钠可以随意调整。所以为了除去这些离子,需要依次加入稍过量的NaOH、BaCl2、Na2CO3,然后过滤。在溶液中再加适量盐酸,加热蒸干溶液即得到精盐。
(2)用玻璃棒蘸浓氨水检验阳极产生的气体,发现产生大量白烟,该白烟应该是氯化铵固体颗粒。这说明反应中有氯化氢生成,因此阳极产生的是氯气。氯气具有强氧化性,能把氨气氧化生成氮气和氯化氢,然后氯化氢与氨气反应即产生白烟。
(3)MgCl2是强酸弱碱盐,镁离子容易水解,MgCl2 + 2H2O Mg(OH)2 + 2HCl。水解吸热,加热促进水解,所以在HCl 气流中,可以抑制MgCl2水解,同时带走水分,从而得到氯化镁晶体。
Mg(OH)2 + 2HCl。水解吸热,加热促进水解,所以在HCl 气流中,可以抑制MgCl2水解,同时带走水分,从而得到氯化镁晶体。
(4)在氧化还原反应中还原剂的还原性强于还原产物的还原性,所以根据苦卤中通入Cl2置换出Br2可知,还原性应该是溴离子强于氯离子。吹出后用SO2吸收转化为Br-,这说明在反应中单质溴把SO2氧化生成硫酸和溴化氢,所以SO2的还原性强于溴离子的还原性,由此可得出Cl-、SO2、Br-还原性由强到弱的顺序是SO2>Br->Cl-。
