某兴趣小组设计如下图实验装置进行实验。
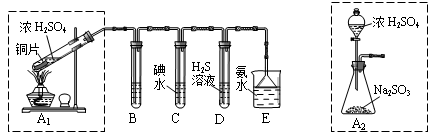
Ⅰ、探究大气污染物SO2的性质
(1)为了实现绿色环保的目标,能否用上图A2代替A1装置 (填“能”或“否”)。
(2)B、C、D分别用于检验SO2的漂白性、还原性和氧化性,则B中所盛试剂
为 ,C中反应的离子方程式为 ,D中反应的化学方程式
为 。
Ⅱ、探究铜片与浓H2SO4反应的产物
实验结束,发现在铜片表面附着黑色固体。查阅资料得知:此黑色固体可
能含有CuO、CuS、Cu2S。常温下CuS和Cu2S都不溶于稀盐酸,在空气中煅烧都转化为Cu2O和SO2。该小组同学收集一定量黑色固体,按如下实验方案探究其成分:
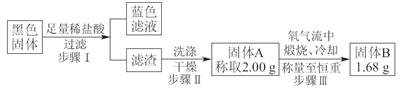
(3)步骤Ⅱ 中检验滤渣洗涤干净的实验方法是____________________________。
(4)黑色固体的成分是________________。
Ⅲ、尾气处理
用氨水吸收尾气中的SO2,“吸收液”中可能含有OH-、SO32-、SO42-、HSO3-等阴离子。
(5)氨水吸收过量SO2的反应的离子方程为 。
(1)能(1分)
(2)品红溶液(1分) SO2+I2+2H2O=SO42-+2 I-+4H+(2分) SO2+2H2S="3S↓+" 2H2O(2分)
(3)取最后一次洗涤液少许,滴加少量AgNO3溶液,若无明显现象,则洗涤干净(2分)
(4)CuO、CuS、Cu2S(2分)
(5)NH3·H2O+SO2=NH4++HSO3-(2分)
题目分析:(1)A2装置不需要加热,且可以控制加入浓硫酸的量控制反应进行,更环保;(2)检验SO2漂白性一般用品红试剂,C中SO2与碘单质反应,D中与H2S反应归中反应;(3)取最后一次洗涤液少许,滴加少量AgNO3溶液,若无明显现象,则洗涤干净,强调最后一次洗涤液;(4)根据步骤Ⅰ产生蓝色溶液得出固体含有CuO,根据最后煅烧后质量的变化计算:若全为CuS,最后得到沉淀的质量应为2÷96÷2×144=1.5g,若全为Cu2S,最后得到沉淀的质量应为2÷160×144=1.8g,故两种物质均含有。(5)过量SO2应生成亚硫酸氢铵。
