现有一瓶未开启的浓硫酸,试剂瓶标签上的部分内容如图所示.

(1)H2SO4的相对分子质量是______.
(2)H2SO4分子中,H、S、O的原子个数比为______.
(3)该瓶浓硫酸的质量为______g.
(4)用100g98%的该浓硫酸稀释成19.6%的稀硫酸,需要水多少g?
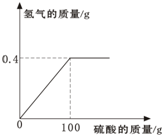
(5)某同学用锌粒与19.6%的稀硫酸反应制取氢气,反应所用的稀硫酸和生成氢气的关系如右图.
计算:
①至少需要多少g的锌粒?
②完全反应后所得溶液的溶质质量分数为多少?(保留一位小数点)
(1)相对分子质量为各元素相对原子质量的和,所以H2SO4的相对分子质量=2×1+32+16×4=98;
(2)化学式中各元素原子的角码之比即是分子中原子的个数比,所以H2SO4分子中,H、S、O的原子个数比为2:1:4;
(3)依据密度公式ρ=
的变形可知m=ρV,所以该瓶硫酸的质量=1.84g/cm3×500ml=920g;m v
(4)设需要水质量为x
100g×98%=(100g+x)×19.6%
x=400g
(5)①设需要锌的质量为x,生成ZnSO4质量为y
H2SO4+Zn=ZnSO4+H2↑
65 161 2
x y 0.4g
=65 x
=2 0.4g 161 y
x=13g
y=32.2g
②反应后所得溶液的质量为:100g+13g-0.4g,所以其溶质的质量分数为
×100%=28.6%32.2g (100+13-0.4)g
故答案为:(1)98;(2)2:1:4;(3)920;(4)答:需要水400g;(5)答:至少需要13g锌粒;②完全反应后所得溶液的溶质质量分数为28.6%.
