某化学实验室产生的废液中含有Fe3+、Cu2+、Ba2+、Cl-四种离子,现设计下列方案对废液进行处理,以回收金属并制备氯化钡、氯化铁晶体。
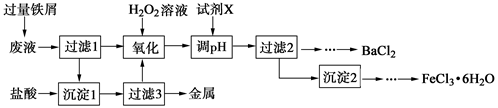
(1)沉淀1中含有的金属单质是 。
(2)氧化时加入H2O2溶液发生反应的离子方程式为 。
(3)下列物质中,可以作为试剂X的是 (填字母)。
A.BaCl2
B.BaCO3
C.NaOH
D.Ba(OH)2(4)检验沉淀2洗涤是否完全的方法是 。
(5)制备氯化铁晶体过程中需保持盐酸过量,其目的是 。
(6)由过滤2得到的滤液制备BaCl2的实验操作依次为 、冷却结晶、 、洗涤、干燥。
(1)铁、铜(2分,各1分)
(2)2Fe2++2H++H2O2=2Fe3++2H2O(2分)
(3)BD(2分,各1分)
(4)取最后一次洗涤液少许,滴入1~2滴硫酸钠溶液,若不出现白色浑浊,表明已洗涤完全。(或取最后一次洗涤液少许,滴入1~2滴硝酸银溶液,若不出现白色浑浊,表明已洗涤完全。)(2分)
(5)抑制Fe3+水解(合理答案均可)(2分)
(6)蒸发浓缩 过滤(2分,各1分)
题目分析:(1)加入铁屑能把铜置换出来,同时又铁剩余,沉淀为铁、铜;(2)流程中需把亚铁离子氧化为铁离子后再沉淀除去,双氧水氧化Fe2+;(3)加入X试剂是为了调节pH使铁离子生成氢氧化铁沉淀,为了不引入新杂质可以加入BaCO3、Ba(OH)2等物质;(4)检验沉淀洗涤是否干净一般应取最后次的滤液检验可能含有的杂质离子,一般检验硫酸根离子、氯离子等;(5)氯化铁在水溶液中水解,加如盐酸过量能抑制Fe3+水解;(6)过滤后得到的溶液为稀溶液,从溶液中得到晶体可以采用蒸发浓缩降温结晶的方法。
