通过沉淀-氧化法处理含铬废水,减少废液排放对环境的污染,同时回收
K2Cr2O7。实验室对含铬废液(含有Cr3+、Fe3+、K+、SO42-、NO3-和少量Cr2O72-)回收与再利用工艺如下:
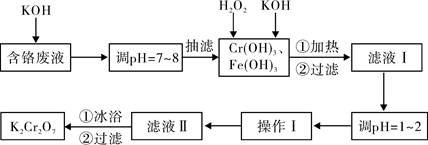
已知:①Cr(OH)3+OH-=CrO2-+2H2O;
②2CrO2-+3H2O2+2OH-=2CrO42-+4H2O;
③H2O2在酸性条件下具有还原性,能将+6价Cr还原为+3价Cr。
(1)实验中所用KOH浓度为6 mol·L-1,现用KOH固体配制250mL 6 mol·L-1 的KOH溶液,除烧杯、玻璃棒外,还必需用到的玻璃仪器有 。
(2)由于含铬废液中含有少量的K2Cr2O7,抽滤时可用 代替布氏漏斗;抽滤过程
中要及时观察吸滤瓶内液面高度,当快达到支管口位置时应进行的操作为 。
(3)滤液Ⅰ酸化前,进行加热的目的是 。冰浴、过滤后,应用少量冷水洗涤K2Cr2O7,其目的是 。
(4)下表是相关物质的溶解度数据:
| 物质 | 0℃ | 20℃ | 40℃ | 60℃ | 80℃ | 100℃ |
| KCl | 28.0 | 34.2 | 40.1 | 45.8 | 51.3 | 56.3 |
| K2SO4 | 7.4 | 11.1 | 14.8 | 18.2 | 21.4 | 24.1 |
| K2Cr2O7 | 4.7 | 12.3 | 26.3 | 45.6 | 73.0 | 102.0 |
| KNO3 | 13.9 | 31.6 | 61.3 | 106 | 167 | 246.0 |
根据溶解度数据,操作Ⅰ具体操作步骤为① 、② 。
(5)称取产品重铬酸钾试样2.000g配成250mL溶液,取出25.00mL于锥形瓶中,加入10mL 2 mol·L-1H2SO4和足量碘化钠(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200 mol·L-1Na2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)。
①若实验中共用去Na2S2O3标准溶液30.00mL,所得产品的中重铬酸钾的纯度为 (设整个过程中其它杂质不参与反应)。
②若滴定管在使用前未用Na2S2O3标准溶液润洗,测得的重铬酸钾的纯度将: (填“偏高”、“偏低”或“不变”)。
(1)250 mL容量瓶(1分) 胶头滴管(1分)
(2)玻璃砂漏斗(1分) 拔掉吸滤瓶上的橡皮管,从吸滤瓶上口倒出溶液(2分)
(3)除去H2O2(1分) 除去晶体表面残留的杂质,减小K2Cr2O7的损耗(1分)
(4)蒸发浓缩、趁热过滤(2分)
(5)①88.2%(2分) ②偏高(1分)
题目分析:(1)一定浓度溶液的配制需用一定体积的容量瓶,定容时用胶头滴管;(2)为防止污染不能从支管倒出溶液,溶液应从吸滤瓶上口倒出溶液;(3)双氧水易分解,可加热分解除去;用冷水洗涤除去晶体表面残留的杂质,减小K2Cr2O7的损耗,还可用该饱和溶液洗涤;(4)滤液Ⅰ中含有K+、SO42等杂质,通过操作除去,根据硫酸钾溶解度随温度变化不明显可以采用蒸发浓缩,使硫酸钾结晶,趁热过滤(防止K2Cr2O7结晶损失)除去该杂质。
